

分析 (1)依據二氧化錳與濃鹽酸制備氯氣的方程式計算解答;
(2)氯化銨與氫氧化鈣在加熱條件下反應生成氨氣、氯化鈣和水;
(3)濃鹽酸易揮發,制備的氯氣中含有揮發的氯化氫和水蒸氣雜質,依據氯氣、氯化氫性質選擇合適的除雜劑;
(4)氧化鈣、氫氧化鈉溶于水放出大量的熱,能夠促進氨水的揮發;
(5)氨氣與氯氣反應生成氮氣和氯化氫,氯化氫與氨氣反應生成氯化銨固體;
(6)氯化氫、氨氣、氯氣等都能夠污染空氣需要進行尾氣處理;
(7)氨氣密度小于氯氣密度,為使二者混合均勻充分反應,應左邊較長、右邊較短.
解答 解:(1)二氧化錳與濃鹽酸反應生成氯化錳、水和氯氣,方程式:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成1mol氯氣轉移2mol電子,所以若標況下生成2.24LCl2,其物質的量為0.1mol,則轉移電子的物質的量為0.2mol;
故答案為:0.2mol;
(2)氯化銨與氫氧化鈣在加熱條件下反應生成氨氣、氯化鈣和水,化學方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(3)濃鹽酸易揮發,制備的氯氣中含有揮發的氯化氫和水蒸氣雜質,氯化氫極易溶于水,氯氣在飽和食鹽水中溶解度不大,所以可以選擇飽和食鹽水除去氯化氫;
故答案為:HCl(氯化氫);
(4)氧化鈣、氫氧化鈉溶于水放出大量的熱,能夠促進氨水的揮發;
故答案為:燒堿(氫氧化鈉)、生石灰;
(5)氨氣與氯氣反應生成氮氣和氯化氫,氯化氫與氨氣反應生成氯化銨固體,化學方程式為8NH3+3Cl2=N2+6NH4Cl;
故答案為:8NH3+3Cl2=N2+6NH4Cl;
(6)氯化氫、氨氣、氯氣等都能夠污染空氣需要進行尾氣處理
故答案為:C中缺少尾氣處理裝置;
(7)氨氣密度小于氯氣密度,為使二者混合均勻充分反應,應左邊較長、右邊較短;
故答案為:使氨氣與氯氣能夠混合均勻,快速且充分反應.
點評 本題考查了物質的制備,設計氨氣、氯氣的制備及性質的檢驗,熟悉反應原理及物質的性質是解題關鍵,題目難度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:選擇題
| A. | C11H24、C27H56、C29H60三種物質互為同系物 | |
| B. | C33H68在常溫下為液態 | |
| C. | C35H72中氫原子被氯氣取代,最多需氯氣35mol | |
| D. | 正二十一烷分子中所有碳原子在一條直線上 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氧化鋁的熔點很高,所以不可以用來冶煉鋁 | |
| B. | 氫氧化鋁是一種膠狀沉淀,有較大表面積,有吸附性,可用作凈水劑 | |
| C. | 實驗室可以用氫氧化鈉與氯化鋁來制備氫氧化鋁 | |
| D. | 氫氧化鋁既可與強酸反應又可與強堿反應,是兩性氫氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
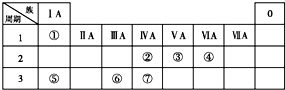 下表為元素周期表的一部分,請參照①~⑦相關元素在表中的位置,用化學用語回答下列問題:
下表為元素周期表的一部分,請參照①~⑦相關元素在表中的位置,用化學用語回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
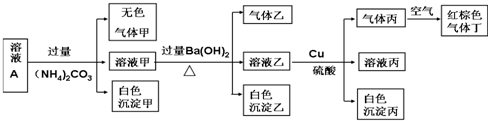
| A. | 該溶液中一定有上述離子中的NO3-、Al3+、SO42-、Cl-四種離子 | |
| B. | 實驗消耗Cu 14.4g,則生成氣體丁的體積為3.36L | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 一定沒有Fe3+,但是無法確定是否含有I- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | CO2屬于酸性氧化物 | |
| B. | CO與O形成化學鍵的過程中放出能量 | |
| C. | 釕催化劑可以改變該反應的焓變 | |
| D. | CO與O形成化學鍵的過程中有電子轉移 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com