
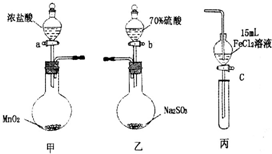
 為驗證氧化性C12>Fe3+>SO2某小組用下圖所示裝置進行實驗(夾持儀器和甲中加熱裝置已略,氣密性已檢驗).
為驗證氧化性C12>Fe3+>SO2某小組用下圖所示裝置進行實驗(夾持儀器和甲中加熱裝置已略,氣密性已檢驗).| 步驟3溶液中含有的離子 | 步驟5溶液中含有的離子 | |||
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO
| ||
| Ⅱ | 有Fe3+無Fe2+ | 有SO
| ||
| Ⅲ | 有Fe3+無Fe2+ | 有Fe2+ |
| ||
| ||


科目:高中化學 來源: 題型:
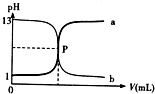
| A、P 點時反應恰好完全中和,溶液呈中性 |
| B、鹽酸的物質的量濃度為1mol/L |
| C、曲線a是鹽酸滴定氫氧化鈉的滴定曲線 |
| D、酚酞不能用做本實驗的指示劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、(NH4)2CO3 |
| B、NH4CNO |
| C、CH3COONH4 |
| D、NH4NO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、先配制一定量的0.10mol?L-1氨水,然后測溶液的pH,若pH小于13,則可證明一水合氨為弱電解質. |
| B、先分別配制一定量0.01mol?L-1氨水和0.10mol?L-1氨水,分別用pH計測它們的pH,若兩者的pH相差小于1個單位,則可證明一水合氨是弱電解質. |
| C、先測0.10mol?L-1 氨水的pH,然后將其加熱至100℃,再測pH,如果pH變大則可證明一水合氨是弱電解質. |
| D、配制一定量的NH4Cl溶液.測pH.若常溫下pH小于7.則證明一水合氨是弱電解質. |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
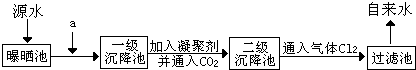
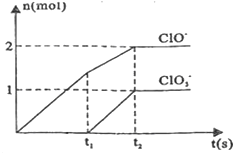
| 1 |
| 2 |
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 硫--碘循環分解水制氫主要涉及下列反應:
硫--碘循環分解水制氫主要涉及下列反應:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com