
“神七”登天標志著我國的航天事業進入了新的篇章。
(1)火箭升空時,由于與大氣層的劇烈摩擦,產生高溫。為了防止火箭溫度過高,在火箭一面涂上一種特殊的涂料,該涂料的性質最可能的是 。
| A.在高溫下不融化 | B.在高溫下可分解氣化 |
| C.在常溫下就分解氣化 | D.該涂料不可能發生分解 |

 CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1 CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1
CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1 CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1 (1)B (2)1 2 3 4 ;2:1 產物無污染(3)H2-2e-+2OH-=2H2O 2
(4)2CO2+4e-+2H2O=2CO+4OH- 不可行 △H>0,吸熱 △S<0 (5)(124.2)
解析試題分析:該涂料的性質最可能的是在高溫下可分解氣化。分解吸熱,產物氣化也消耗大量的能量,可以使火箭溫度降低。選項為:B。(2)火箭升空需要產生高能的反應的方程式是1N2O4+2N2H4==3N2+4H2O。系數是1 2 3 4。該反應中被氧化N2H4中的N的原子與被還原的原子的N2O4中的N原子的物質的量之比是2:1. 這個反應應用于火箭推進器,除釋放大量的熱和快速產生大量氣體外,還有一個很大的優點是產物無污染、潔凈、環保。(3)在氫氧燃料電池中,通入H2的電極作負極,發生的電極反應為:H2-2e-+2OH-=2H2O. 2H2O------2H2↑+ O2↑。產生氣體3mol,轉移電子4mol.現在產生氣體共1.5mol,所以轉移電子2mol.(4)根據總反應式及陽極的電極反應式可得到陰極反應為:2CO2+4e-+2H2O=2CO+4OH- 有人設計2CO=2C+O2(△H>0、△S<0)來消除CO的污染的方案不可行。原因是該反應的△H>0,是吸熱反應;△S<0,體系的混亂程度減小。(5)①-②整理得:C3H8(g)  CH3CH=CH2(g)+H2(g)的△H=124.2KJ/mol.
CH3CH=CH2(g)+H2(g)的△H=124.2KJ/mol.
考點:考查航天事業涉及到的各種問題及化學反應、處理方法等的知識。


科目:高中化學 來源: 題型:填空題
過氧化氫(H2O2)是一種無色黏稠液體,它的水溶液俗稱雙氧水,呈弱酸性,常用作無公害的消毒殺菌劑和漂白劑等。
(1)下列說法正確的是 。
| A.過氧化氫分子中既有極性鍵又有非極性鍵 |
| B.H2O2與H2O互為同素異形體 |
| C.34 g H2O2中含有的陰離子數為NA |
| D.實驗室可以利用過氧化氫制取氧氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
利用化合價和物質類別推測物質的性質是化學研究的重要手段。
(1)從化合價的角度可以預測物質的性質。
①SO2的性質___________(填序號,下同);
A.只有氧化性 B.只有還原性 C.既有氧化性又有還原性
②將SO2通入酸性KMnO4溶液中,溶液由紫色褪至無色。反應結束后,硫元素存在形式合理的是__________。
A.S2— B.S C.SO32— D.SO42—
(2)從物質分類的角度可以推測物質的性質。現有由MgO、Al2O3、Fe2O3、SiO2組成的某混合物試樣。
①其中Al2O3屬于_______氧化物,MgO和Fe2O3屬于_________氧化物(填“酸性”、“堿性”或“兩性”);
②將試樣溶于過量的鹽酸中,過濾,濾渣的主要成分是_________;再向濾液中加入NaOH溶液至過量,過濾,濾渣中的主要成分是_________;
③若將該試樣直接溶于過量的NaOH溶液中,所發生的反應的化學方程式是______________________(可任意寫其中一個)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氮氣及含氮的化合物在國民經濟中占有重要地位。合成氨工業中,合成塔中每產生2 mol NH3,放出92.4 kJ熱量。
(1)若起始時向容器內放入2 mol N2和6 mol H2,達平衡后放出的熱量為Q,則Q_____184.8kJ(填“>”、“<”或“=”) 。 一定條件下,在密閉恒容的容器中,能表示反應達到化學平衡狀態的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合氣體密度保持不變 d.c(N2):c(H2):c(NH3)=1:3:2
工業生產尿素的原理是以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
(2)在一定溫度和壓強下,若原料氣中的NH3和CO2的物質的量之比(氨碳比)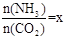 ,右圖是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是___________。
,右圖是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是___________。
(3)圖中的B點處,NH3的平衡轉化率為_______。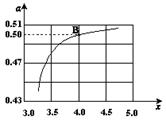
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化還原反應方程式,再標出電子轉移的方向和數目:
12Cl2+15NH3→ ――③
(5)反應③中的還原劑是 ,還原產物是 。
(6)若按③反應后產生氣體9.408L(標準狀況),則被氧化的氣體的物質的量是 mol。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫酸工廠的煙氣中含有SO2,有多種方法可實現煙氣脫硫。
(1)工業制硫酸的過程中,SO2被氧氣氧化的化學方程式為 。
(2)“濕式吸收法”利用吸收劑與SO2發生反應從而脫硫。
已知:25℃時,H2SO3  HSO3 -+H+ K=1.5×10-2
HSO3 -+H+ K=1.5×10-2
H2CO3 HCO3 -+H+ K=4.4×10-7
HCO3 -+H+ K=4.4×10-7
下列試劑中適合用作該法吸收劑的是 (填字母序號)。
a.石灰乳 b. Na2SO3溶液 c. Na2CO3溶液
②“鈉堿法”用NaOH溶液作吸收劑,向100 mL 0.2 mol·L-1的NaOH溶液中通入標準狀況下0.448 L SO2氣體,反應后測得溶液pH<7,則溶液中下列各離子濃度關系正確的是 (填字母序號)。
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
(3)某硫酸廠擬用煙氣處理含Cr2O72-的酸性廢水,在脫硫的同時制備Cr2O3產品。具體流程如下: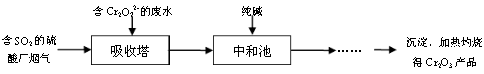
①吸收塔中反應后的鉻元素以Cr3+形式存在,則其中發生反應的離子方程式為 。
②中和池中的反應除生成Cr(OH)3沉淀外,還會產生某種氣體,該氣體的化學式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I(1)在淀粉碘化鉀溶液中通入少量氯氣,立即會看到溶液變藍色,反應的離子方程式是 。
(2)在碘和淀粉形成的藍色溶液中通入SO2氣體,發現藍色逐漸消失,反應的離子方程是 。
(3)對比(1)和(2)實驗所得的結果,將Cl 、I
、I SO2按還原性由強到弱順序排列為 。
SO2按還原性由強到弱順序排列為 。
II (4) 除去鐵粉中混有鋁粉的試劑是 ,離子方程式為
(5) 1mol過氧化鈉與2mol碳酸氫鈉固體混合后,在密閉容器中加熱充分反應,排出氣體物質后冷卻,殘留的固體物質是
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知氧化還原反應與四種基本反應類型的關系可用如圖表示,下列是有水參加或生成的幾種反應:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO  Cu +H2O
Cu +H2O
④3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
請回答下列問題:
(1)反應①中水 (填字母)。
| A.是氧化劑 |
| B.是還原劑 |
| C.既是氧化劑又是還原劑 |
| D.既不是氧化劑又不是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫。請運用化學反應原理的相關知識研究碳及其化合物的性質。
(1)近年來,我國儲氫納米碳管研究取得重大進展,用電弧法合成的碳納米管中常伴有大量碳納米顆粒(雜質),這種碳納米顆粒可用氧化氣化法提純,其反應的化學方程式為:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
請完成并配平上述化學方程式。
(2)甲醇是一種新型燃料,甲醇燃料電池即將從實驗室走向工業化生產。工業上一般以CO和H2為原料合成甲醇,該反應的熱化學方程式為:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大該反應的反應速率的是 _______;
| A.隨時將CH3OH與反應混合物分離 | B.降低反應溫度 |
| C.增大體系壓強 | D.使用高效催化劑 |
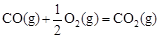 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1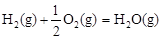 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1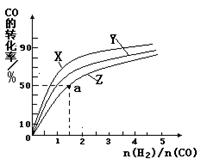
 CH3OH(g)的平衡常數K = 。
CH3OH(g)的平衡常數K = 。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氧化還原反應規律是化學學科的重要規律之一。按要求回答下列問題:
(1) 被稱為萬能還原劑的NaBH4溶于水并和水反應:NaBH4+2H2O=NaBO2+4H2↑,此反應中B元素的化合價沒有發生變化,則NaBH4中H的化合價為___________,該反應氧化產物是______________,還原產物是______________。
(2) 有下列三個反應:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根據以上方程式可以得到Fe2+、Co2+、Br-、I-還原性由強的弱的順序為_________;
②1molCo2O3能氧化HCl的物質的量_____________。
(3) 完成并配平下列化學反應方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一個完整的氧化還原反應方程式可以拆寫成兩個“半反應式”,一個是“氧化反應式”,一個是“還原反應式”。如2H+ +Zn=Zn2++H2↑,可拆寫為氧化反應式:Zn-2e-=Zn 2+,還原反應式:2H++ 2e-=H2↑。并由此實現了化學能與電能的相互轉化。據此,回答下列問題:
①將2Fe3++Cu= 2Fe2+ +Cu2+拆寫為兩個“半反應式”:其中,氧化反應式為 。
②由①中的反應,可設計成如右圖所示的原電池:
若電極a為Cu ,電解質溶液甲的化學式為 ;
電極b處的電極反應式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com