考點:晶胞的計算,元素電離能、電負性的含義及應用,極性鍵和非極性鍵,原子軌道雜化方式及雜化類型判斷
專題:原子組成與結構專題,化學鍵與晶體結構
分析:周期表前四周期的元素a、b、c、d、e,原子序數依次增大,a的核外電子總數與其周期數相同,則a為H元素;
c的最外層電子數為其內層電子數的3倍,最外層電子數不超過8個,則c是O元素;
b的價電子層中的未成對電子有3個,且原子序數小于c,則b是N元素;
e的最外層只有1個電子,但次外層有18個電子,則e原子核外電子數為2+8+18+1=29,為Cu元素;
d與c同族,且原子序數小于e,所以d為S元素,
(1)同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族和第VA族元素第一電離能大于其相鄰元素,同一主族元素中,元素第一電離能隨著原子序數增大而減小;e的價層電子為3d、4s電子;
(2)a和其他元素形成的二元共價化合物中,分子呈三角錐形,該分子為NH
3,根據價層電子對互斥理論確定該分子的中心原子的雜化方式;
分子中既含有極性共價鍵、又含有非極性共價鍵的化合物有雙氧水和肼;
(3)這些元素形成的含氧酸中,分子的中心原子的價層電子對數為3的酸是亞硝酸;酸根呈三角錐結構,說明該酸根離子價層電子對個數是4且含有一個孤電子對;
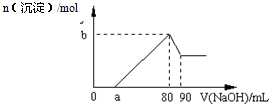
(4)該晶胞中c離子個數=1+8×
=2,e離子個數4,所以e和c形成的一種離子化合物化學式為Cu
2O,據此判斷e離子的電荷;
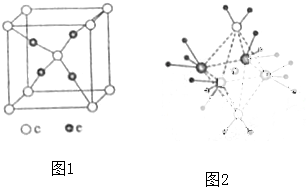
(5)這5種元素形成的一種1:1型離子化合物中,陰離子呈四面體結構,說明該陰離子價層電子對個數是4且不含孤電子對;陽離子呈軸向狹長的八面體結構,根據圖知,其陽離子中銅離子配位數是8,在八面體上下頂點上分子含有兩個共價鍵且含有兩個孤電子對,為水分子,有兩個,正方形平面上四個頂點上分子含有3個共價鍵且含有一個孤電子對,所以為氨氣分子,有4個;
陽離子中存在共價鍵和配位鍵;H
2O和Cu
2+的配位鍵比NH
3與Cu
2+的弱,所以該化合物加熱時首先失去的組分是H
2O.
解答:
解:周期表前四周期的元素a、b、c、d、e,原子序數依次增大,a的核外電子總數與其周期數相同,則a為H元素;
c的最外層電子數為其內層電子數的3倍,最外層電子數不超過8個,則c是O元素;
b的價電子層中的未成對電子有3個,且原子序數小于c,則b是N元素;
e的最外層只有1個電子,但次外層有18個電子,則e原子核外電子數為2+8+18+1=29,為Cu元素;
d與c同族,且原子序數小于e,所以d為S元素,
(1)同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族和第VA族元素第一電離能大于其相鄰元素,同一主族元素中,元素第一電離能隨著原子序數增大而減小,所以b、c、d元素第一電離能最大的是N元素;e的價層電子為3d、4s電子,其價層電子排布圖為

,
故答案為:N;

;
(2)a和其他元素形成的二元共價化合物中,分子呈三角錐形,該分子為NH
3,該分子的中心原子含有3個共價單鍵和一個孤電子對,所以N原子的雜化方式為sp
3;
分子中既含有極性共價鍵、又含有非極性共價鍵的化合物有H
2O
2和N
2H
4,
故答案為:sp
3;H
2O
2和N
2H
4;
(3)這些元素形成的含氧酸中,分子的中心原子的價層電子對數為3的酸是HNO
2、HNO
3;酸根呈三角錐結構的酸是H
2SO
3,故答案為:HNO
2、HNO
3;H
2SO
3;
(4)該晶胞中c離子個數=1+8×
=2,e離子個數4,該晶胞中氧離子和銅離子個數之比=2:4=1:2,所以e和c形成的一種離子化合物化學式為Cu
2O,則e離子的電荷為+1,故答案為:+1;
(5)這5種元素形成的一種1:1型離子化合物中,陰離子呈四面體結構,說明該陰離子價層電子對個數是4且不含孤電子對,為SO
42-;
陽離子呈軸向狹長的八面體結構,根據圖知,其陽離子中銅離子配位數是8,在八面體上下頂點上分子含有兩個共價鍵且含有兩個孤電子對,為水分子,有兩個,正方形平面上四個頂點上分子含有3個共價鍵且含有一個孤電子對,所以為氨氣分子,有4個,所以陽離子中含有配位鍵和共價鍵;
H
2O和Cu
2+的配位鍵比NH
3與Cu
2+的弱,所以該化合物加熱時首先失去的組分是H
2O,
故答案為:SO
42-;共價鍵和配位鍵;H
2O;H
2O和Cu
2+的配位鍵比NH
3與Cu
2+的弱.
點評:本題考查物質結構和性質,側重考查學生空間想象能力、知識運用能力,涉及晶胞計算、配合物、原子結構等知識點,綜合性較強,采用均攤法、價層電子對互斥理論等理論分析解答,題目難度中等,注意:配位鍵也屬于共價鍵.

 ,
, ;
;