
| A. | 高溫下焦炭還原二氧化硅制得粗硅 | |
| B. | 可用Na從TiCl4的水溶液中生產Ti | |
| C. | 可用CO高溫下還原赤鐵礦煉鐵 | |
| D. | 可用石英、石灰石、純堿在高溫下生產玻璃 |
分析 A、工業上用碳還原二氧化硅反應生成硅和一氧化碳;
B、鈉易和水反應生成氫氧化鈉和氫氣,所以該反應不能在水溶液中進行;
C.高溫下CO還原赤鐵礦氧化鐵可以得到金屬鐵和二氧化碳;
D、制玻璃的原料是:石灰石、純堿、石英.
解答 解:A、工業上用碳還原二氧化硅的辦法來獲得粗硅,故A正確;
B、鈉易和水反應生成氫氧化鈉和氫氣,所以該反應不能在水溶液中進行,只能在熔融狀態下發生置換反應,故B錯誤;
C.高溫下CO還原赤鐵礦氧化鐵可以得到金屬鐵,此方法用于煉鐵,故C正確;
D、制玻璃的原料是:石灰石、純堿、石英,三者在玻璃熔爐中高溫熔融可制得玻璃,故D正確;
故選B.
點評 本題綜合考查學生物質的性質以及應用方面的知識,注意知識的歸納和梳理是關鍵,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| B. | 飽和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 CH3COONa溶液:H+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 簡單離子半徑:Y>Q | |
| B. | Q分別與X、Z形成的最簡單化合物中化學鍵類型相同 | |
| C. | YW能與WQ發生復分解反應 | |
| D. | 最簡單氣態氫化物的穩定性:X<Z |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “酸雨”、“溫室效應”的形成都與化石燃料的燃燒有關 | |
| B. | NaHCO3是焙制糕點所用的發酵粉的主要成分之一 | |
| C. | 氫氧化鐵膠體具有吸附性,因而常用于凈水 | |
| D. | 硫酸鋇在醫學上用作鋇餐,Ba2+對人體無毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2在Cl2中劇烈燃燒,發出黃色火焰,冒白煙 | |
| B. | SiO2的化學性質不活潑,不與任何酸發生反應 | |
| C. | 常溫下,鋁、鐵遇濃硫酸會發生鈍化反應 | |
| D. | 將氯氣通入紫色石蕊試液中一些時間后,溶液變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A~I為中學化學中常見的物質,B、E、F為單質,且在常溫下B是一種黃綠色有毒氣體,E為紫紅色金屬,G為黑色固體.它們的相互轉化關系如圖所示(部分生成物未列出).請回答下列問題:
A~I為中學化學中常見的物質,B、E、F為單質,且在常溫下B是一種黃綠色有毒氣體,E為紫紅色金屬,G為黑色固體.它們的相互轉化關系如圖所示(部分生成物未列出).請回答下列問題: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
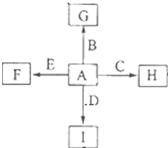 如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物,已知:
如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;
; HClO+OH-;
HClO+OH-;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com