
 ,ci2與ce2比較,沸點較高的是CS2(寫分子式).
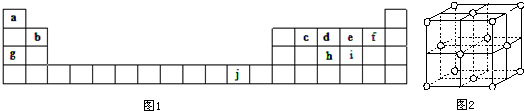
,ci2與ce2比較,沸點較高的是CS2(寫分子式).分析 根據元素在周期表中的位置可知,a為H元素、b為Be元素、c為C元素、d為N元素、e為O元素、f為F元素、g為Na元素、h為P元素、i為S元素、j為Cu元素;
(1)j為Cu元素,原子核外電子數目為29,根據核外電子排布規律書寫;a為H元素、c為C元素,則ca4分子為CH4,元素C為sp3雜化;
(2)CO2與CS2比較,分子結構相似,為分子晶體,分子晶體的熔沸點高低取決于相對分子質量的大小;
(3)da3與ha3相比,NH3的沸點要高得多原因為NH3分子間形成氫鍵;
(4)同周期自左而右第一電離能呈增大趨勢,當元素原子各軌道處于半滿、全滿、全空時,能量較低,第一電離能高于同周期相鄰元素;
金屬性越弱,電負性越大;
(5)原子總數相等,價電子總數相等的微粒互為等電子體;
(6)氫氧化銅與溶于氨水形成四氨合銅絡離子;
(7)根據均攤法計算晶胞中原子數目.
解答 解:根據元素在周期表中的位置可知,a為H元素、b為Be元素、c為C元素、d為N元素、e為O元素、f為F元素、g為Na元素、h為P元素、i為S元素、j為Cu元素;
(1)j為Cu元素,原子核外電子數目為29,核外電子排布式為1s22s22p63s23p63d104s1;a為H元素、c為C元素,則ca4分子為CH4,元素C為sp3雜化,分子的空間構型為正四面體,故答案為:1s22s22p63s23p63d104s1;sp3;正四面體;
(2)ci2分子為CS2,硫原子與碳原子之間形成2對共用電子對,電子式為 ;ce2的分子式CO2,與CS2比較,二硫化碳的熔沸點高,因為:分子結構相似,為分子晶體,分子晶體的熔沸點高低取決于相對分子質量的大小,
;ce2的分子式CO2,與CS2比較,二硫化碳的熔沸點高,因為:分子結構相似,為分子晶體,分子晶體的熔沸點高低取決于相對分子質量的大小,
故答案為: ;CS2;
;CS2;
(3)da3與ha3相比,NH3的沸點要高得多原因為NH3分子間形成氫鍵,故答案為:NH3分子間形成氫鍵;
(4)P元素的3p軌道為半滿穩定狀態,能量降低,故第一電離能P>S;金屬性Na>Be,金屬性越強,電負性越小,故電負性Na<Be,故答案為:>;<;
(5)ce2分子為CO2,其等電子體的粒子為CS2等,故答案為:CS2;
(6)氫氧化銅與溶于氨水形成[Cu(NH3)4]2+,離子方程式為:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案為:[Cu(NH3)4]2+;
(7)由Cu晶胞可知,晶胞中含有Cu原子數目為6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,
故答案為:4.
點評 本題是對物質結構與性質綜合考查,知識點考查全面,難度不大,屬于知識點的羅列,注意基礎知識的全面掌握.


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:選擇題
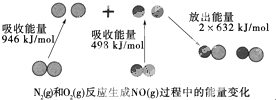 化學反應中的能量變化是由化學反應中舊化學鍵斷裂時吸收的能量與新化學鍵形成時放出的能量不同引起的.如圖為N2(g)和O(g)反應生成NO(g)過程中的能量變化:下列說法中正確的是( )
化學反應中的能量變化是由化學反應中舊化學鍵斷裂時吸收的能量與新化學鍵形成時放出的能量不同引起的.如圖為N2(g)和O(g)反應生成NO(g)過程中的能量變化:下列說法中正確的是( )| A. | 1 mol N2(g)和1 mol O2(g)反應放出的能量為180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的總能量小于2 mol NO(g)具有的總能量 | |
| C. | 通常情況下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一種酸性氧化物,能與NaOH溶液反應生成鹽和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④ | B. | ①③ | C. | ①②③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氟一氯甲院 (CHClF2)中所有原子最外層都達到了8電子穩定結構 | |
| B. | “塑料王”不能使酸性高錳酸鉀溶液褪色 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一個平面上 | |
| D. | 三氯甲烷(CHCl3)可以用甲院與氯氣的取代反應來制取 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
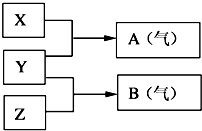 Ⅰ:A、B、W、D、E為短周期元素,且原子序數依次增大,質子數之和為39,B、W 同周期,A、D同主族,A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等.
Ⅰ:A、B、W、D、E為短周期元素,且原子序數依次增大,質子數之和為39,B、W 同周期,A、D同主族,A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等.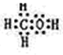 .
.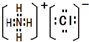 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A組 | B組 |
| Ⅰ.H-I鍵鍵能大于H-Cl鍵鍵能 Ⅱ.H-I鍵鍵能小于H-Cl鍵鍵能 Ⅲ.HI分子間作用力大于HCl分子間作用力 Ⅳ.HI分子間作用力小于HCl分子間作用力 | ①HI比HCl穩定 ②HI比HCl不穩定 ③HI沸點比HCl高 ④HI沸點比HCl低 |
| A. | Ⅰ、① | B. | Ⅳ、② | C. | Ⅲ、③ | D. | Ⅱ、④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:3 | B. | 3:2 | C. | 1:1 | D. | 2:1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com