
【題目】由B、N及Mg、Ni等元素組成的新型材料有著廣泛的用途,回答下列向題:
(1)Ni2+元素基態原子的電子排布式為____________。
(2)經測定發現,N2O5固體由NO2+和NO3-同種離子組成,該固體中N原子雜化類型為_____;與NO2+互為等電子體的微粒有______(寫出一種)。
(3)銨鹽大多不穩定。NH4F、NH4I中,較易分解的是______,原因是____________。
(4)第二周期中,第一電離能介于B元素和N元素間的元素為_______(填元素符號)
(5)已知NiO的晶體結構如圖所示。
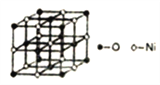
①NiO的晶體結構可描述為:氧原子位于面心和頂點,氧原子可形成正八面體空隙和正四面體空隙,鎳原子填充在氧原子形成的空隙中。則NiO晶體中鎳原子填充在氧原子形成的____體空隙中。
②已知MgO與NiO的晶體結構相同,其中Mg2+和Ni2+的離子半徑分別為66pm和69pm,則熔點MgO______NiO(填“>”、“<”或“=”),理由是___________。
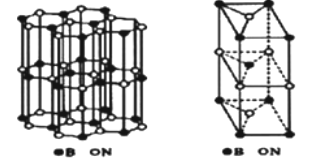
(6)硼和氮構成的一種氮化硼晶體的結構與石墨晶體結構相類似B、N原子相互交替排列如圖左下圖,其晶胞結構如右下圖所示。設層內B-N核間距為apm,面間距為bpm,則該氮化硼晶體的密度為_______g/cm3(用含a、b、NA的代數式表示)。
【答案】 1s22s22p63s23p63d8或[Ar] 3d8 sp、sp2 SCN-、CO2、CS2、N3- 等中的任一種 NH4F F原子半徑比I原子小,H→F鍵比H→I鍵強(H→F更易形成),F-更易奪取NH4+中的H+ Be、C、O 正八面 > Mg2+半徑比Ni2+小, MgO 的晶格能比NiO 大 
【解析】試題分析:(1)Ni2+核外有26個電子,根據能量最低原理書寫電子排布式;(2) NO2+中N原子價電子對數是![]() 、NO3-中N原子價電子對數是
、NO3-中N原子價電子對數是![]() ,根據N原子的價電子對數判斷N原子雜化類型;等電子體是原子數相同、價電子數也相同的微粒;(3) F原子半徑比I原子小,H→F鍵比H→I鍵強;(4)同周期元素從左到右,第一電離能逐漸增大,由于ⅡA元素的S軌道全充滿,第一電離能大于ⅢA元素,ⅤA族元素P軌道半充滿,第一電離能大于ⅥA的元素; (5) ①根據晶胞結構,鎳原子前后、左右、上下各有1個氧原子;②離子半徑越小,晶格能越大;(6)根據晶胞結構圖,每個原子被6個六棱柱共用;利用均攤原則計算1個六棱柱中占用的原子數,根據
,根據N原子的價電子對數判斷N原子雜化類型;等電子體是原子數相同、價電子數也相同的微粒;(3) F原子半徑比I原子小,H→F鍵比H→I鍵強;(4)同周期元素從左到右,第一電離能逐漸增大,由于ⅡA元素的S軌道全充滿,第一電離能大于ⅢA元素,ⅤA族元素P軌道半充滿,第一電離能大于ⅥA的元素; (5) ①根據晶胞結構,鎳原子前后、左右、上下各有1個氧原子;②離子半徑越小,晶格能越大;(6)根據晶胞結構圖,每個原子被6個六棱柱共用;利用均攤原則計算1個六棱柱中占用的原子數,根據![]() 計算密度。
計算密度。
解析:(1)Ni2+核外有26個電子,根據能量最低原理,電子排布式為1s22s22p63s23p63d8;(2) NO2+中N原子價電子對數是![]() ,N原子雜化類型是SP 、NO3-中N原子價電子對數是
,N原子雜化類型是SP 、NO3-中N原子價電子對數是![]() ,N原子雜化類型是sp2;等電子體是原子數相同、價電子數也相同的微粒,所以NO2+的等電子體是SCN-、CO2、CS2、N3- 等;(3) F原子半徑比I原子小,H→F鍵比H→I鍵強,F-更易奪取NH4+中的H+,所以NH4F更易分解;(4)同周期元素從左到右,第一電離能逐漸增大,由于ⅡA元素的S軌道全充滿,第一電離能大于ⅢA元素,ⅤA族元素P軌道半充滿,第一電離能大于ⅥA的元素;所以第二周期中,第一電離能介于B元素和N元素間的元素為Be、C、O;(5) ①根據晶胞結構,鎳原子前后、左右、上下各有1個氧原子,NiO晶體中鎳原子填充在氧原子形成的正八面體空隙中;②離子半徑越小,晶格能越大、熔點越高,Mg2+半徑比Ni2+小, MgO 的晶格能比NiO 大,所以熔點MgO>NiO;(6)根據晶胞結構圖,每個原子被6個六棱柱共用;根據均攤原則1個六棱柱中占用的B原子數是
,N原子雜化類型是sp2;等電子體是原子數相同、價電子數也相同的微粒,所以NO2+的等電子體是SCN-、CO2、CS2、N3- 等;(3) F原子半徑比I原子小,H→F鍵比H→I鍵強,F-更易奪取NH4+中的H+,所以NH4F更易分解;(4)同周期元素從左到右,第一電離能逐漸增大,由于ⅡA元素的S軌道全充滿,第一電離能大于ⅢA元素,ⅤA族元素P軌道半充滿,第一電離能大于ⅥA的元素;所以第二周期中,第一電離能介于B元素和N元素間的元素為Be、C、O;(5) ①根據晶胞結構,鎳原子前后、左右、上下各有1個氧原子,NiO晶體中鎳原子填充在氧原子形成的正八面體空隙中;②離子半徑越小,晶格能越大、熔點越高,Mg2+半徑比Ni2+小, MgO 的晶格能比NiO 大,所以熔點MgO>NiO;(6)根據晶胞結構圖,每個原子被6個六棱柱共用;根據均攤原則1個六棱柱中占用的B原子數是![]() 、N原子數是
、N原子數是![]() ,晶胞的摩爾質量是(11+14)g/mol,晶胞的體積是
,晶胞的摩爾質量是(11+14)g/mol,晶胞的體積是![]() ,所以
,所以![]() g/cm3。
g/cm3。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】工業上利用硫鐵礦燒渣(主要成分為Fe3O4、Fe2O3、FeO、SiO2)為原料制備高檔顏料——鐵紅(Fe2O3),具體生產流程如下:
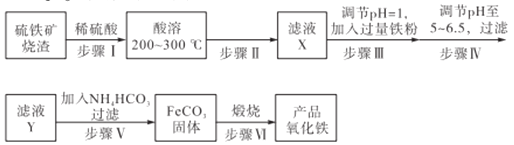
試回答下列問題:
(1)實驗室實現“步驟II”中分離操作所用的玻璃儀器有____、玻璃棒和燒杯等;該步驟是為了除去_______(填相關物質的化學式)。
(2)檢驗步驟III已經進行完全的操作是_______________________。
(3)步驟V的反應溫度一般需控制在35℃以下,其目的是______________;該步驟中反應生成FeCO3的離子反應方程式為___________。
(4)步驟VI中發生反應的化學反應方程式為____________________。
(5)步驟V中,FeCO3達到沉淀溶解平衡時,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,應控制溶液的pH≤_____(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲測定硫鐵礦礦渣中Fe元素的質量分數,稱取ag樣品,充分“酸溶” “水溶”后過濾,向濾液中加入足量的H2O2,充分反應后加入NaOH溶液至不再繼續產生沉淀,經過濾、洗滌、灼燒至固體恒重,冷卻后稱得殘留固體bg,測得該樣品中Fe元素的質量分數為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對分別盛有不同無色溶液①②③④四支試管進行如下操作。現象和結論對應正確的是
操作 | 現象 | 結論 | |
A | 向①中滴加NaOH溶液,加熱,將濕潤紅色石蕊試紙置于試管口 | 試紙變藍 | 原溶液中有NH4+ |
B | 向②中滴入NaHCO3溶液 | 有白色沉淀生成 | 原溶液中有AlO2- |
C | 向③中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
D | 向④中滴加氯水和CCl4,振蕩靜置 | 下層溶液呈橙色 | 原溶液中有I- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】濃度均為0.1mol/L體積均為Vo的HX、HY溶液,分別加水稀釋至體積V,pH隨V的變化關系如下圖所示。下列敘述不正確的是

A. HX的酸性比HY的弱,且HY是強酸
B. NaX溶液中存在關系:c(X-)+c(HX)=c(Na+)
C. 相同溫度下,電離常數K(HX):a=b
D. ![]() ,若同時微熱兩種溶液(不考慮HX、HY和H2O的揮發),則
,若同時微熱兩種溶液(不考慮HX、HY和H2O的揮發),則![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于純凈物、混合物、強電解質、弱電解質和非電解質的組合正確的是
組合 | 純凈物 | 混合物 | 強電解質 | 弱電解質 | 非電解質 |
A | 氨水 | 食鹽水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化鐵 | 家用食醋 | 硫酸鋇 | 碳酸 | 蔗糖 |
C | 膽礬 | 碘酒 | 苛性鈉 | 碳酸 | 碳酸鈣 |
D | 鹽酸 | 氯化鉀溶液 | 氯化鈉 | 氫氧化銅 | 氫氣 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D是原子序數依次增大的第二、三周期主族元素,A、B、C的單質(用a、b、c表示)與化合物x、y、z有如圖所示的轉化關系,B與D同主族。下列說法正確的是

A. 化合物y陰陽離子個數比為1:1
B. 簡單離子半徑:D>C>B
C. 最高價氧化物對應的水化物的酸性:A>D
D. A與D形成的化合物AD2中各原子均滿足8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用圖所示實驗裝置(夾持儀器己略去)探究銅絲與過量濃硫酸的反應.下列實驗不合理的是( )

A. 上下移動①中銅絲可控制SO2的產生與停止
B. ②中選用品紅溶液驗證SO2的生成
C. ③中選用NaOH溶液吸收多余的SO2
D. 為確認有CuSO4生成,向①中加水,觀察顏色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com