
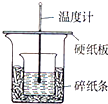
 實驗室利用如圖裝置進行中和熱的測定,請回答下列問題:
實驗室利用如圖裝置進行中和熱的測定,請回答下列問題:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化學 來源: 題型:閱讀理解
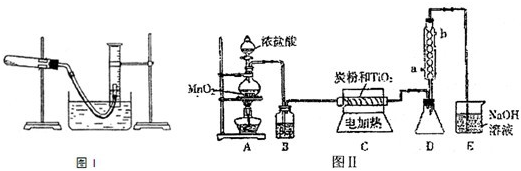
| ||
| ||
| 編號 | 裝置的缺陷和不妥之處 |
| a | TiCl4 遇空氣中水蒸氣發生水解,缺少阻止水蒸氣進入D的裝置 TiCl4 遇空氣中水蒸氣發生水解,缺少阻止水蒸氣進入D的裝置 |
| b | TiCl4 水解產生的氯化氫極易溶于水,需要加上防倒吸的裝置 TiCl4 水解產生的氯化氫極易溶于水,需要加上防倒吸的裝置 |
| … | 由于CO氣體有毒,缺少CO的處理裝置 由于CO氣體有毒,缺少CO的處理裝置 |
查看答案和解析>>
科目:高中化學 來源: 題型:
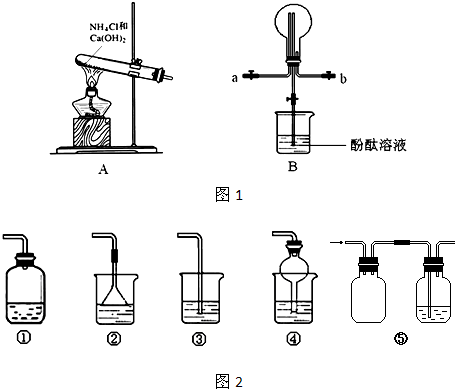
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
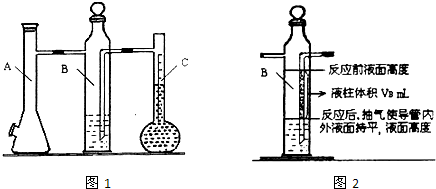
| 實驗次數 | m(Mg)/g | 硫酸體積/mL | 液體量瓶中液體體積/mL | 抽出氣體體積/mL | 氫氣體積/mL | 計算1mol氫體積/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 實驗次數 | m(Mg) g |
硫酸體積mL | 液體量瓶中液體體積mL | 抽出氣體體積mL | B瓶的一段液柱體積mL | 水汽體積百分含量 | 計算1mol氫體積L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年吉林省九校聯合體高三第二次摸底考試理綜化學試卷(解析版) 題型:實驗題
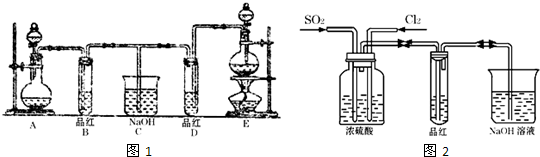
某興趣小組在實驗室用加熱乙醇、濃H2SO4、溴化鈉和少量水的混合物來制備溴乙烷,檢驗反應的部分副產物,并探究溴乙烷的性質。
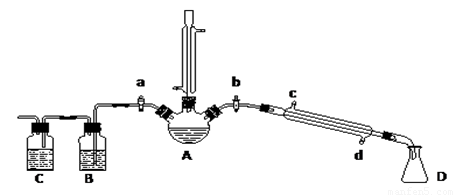
(一)溴乙烷的制備及產物的檢驗:設計了如上圖裝置,其中夾持儀器、加熱儀器及冷卻水管沒有畫出。請根據實驗步驟,回答下列問題:
(1)豎直冷凝管冷凝水流向 口進 口出,豎直冷凝管冷凝的作用
(2)制備操作中,加入的少量的水,其目的是 ;(填字母)
a.減少副產物烯和醚的生成 b.減少Br2的生成
c.減少HBr的揮發 d.水是反應的催化劑
(3)該實驗裝置中 裝置可防止倒吸,中學化學實驗中 用此方法防止倒吸。
(4)理論上,上述反應的副產物還可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氫等:檢驗副產物中是否含有溴化氫:熄滅酒精燈,在豎直冷凝管上方塞上塞子、打開a,利用余熱繼續反應直至冷卻,通過B、C裝置檢驗。B、C中應盛放的試劑分別是 、 。
(5)欲除去溴乙烷中的少量雜質Br2,下列物質中最適合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性質的探究:
用如圖實驗裝置(鐵架臺、酒精燈略) 驗證溴乙烷的性質:

Ⅰ:在試管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振蕩。
II:將試管如圖固定后,水浴加熱。
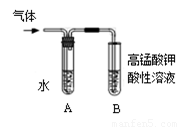
(6)觀察到___________現象時,表明溴乙烷與NaOH溶液已完全反應。
(7)為證明溴乙烷在NaOH乙醇溶液中發生的是消去反應,將生成的氣體通入 如圖裝置。A試管中的水的作用是 ,若無A試管,B試管中的試劑應為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com