
下列圖示與對應敘述相符合的是( )
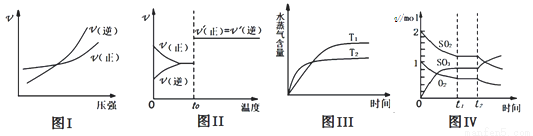
A.圖 I:反應 N2(g)+3H2(g) 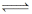 2NH3(g)在恒溫情況下,反應速率與壓強的關系
2NH3(g)在恒溫情況下,反應速率與壓強的關系
B.圖Ⅱ:反應 H2(g)+I2 (g) 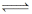 2HI(g)達平衡后,升高溫度時反應速率隨時間變化
2HI(g)達平衡后,升高溫度時反應速率隨時間變化
C.圖Ⅲ:反應 CO2(g)+H2(g) 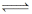 CO(g)+H2O(g) ΔH>0,水蒸氣含量隨時間變化
CO(g)+H2O(g) ΔH>0,水蒸氣含量隨時間變化
D.圖Ⅳ:反應 2SO2(g)+O2(g) 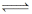 2SO3(g)達平衡后,縮小容器體積各成分物質的量隨時間變化
2SO3(g)達平衡后,縮小容器體積各成分物質的量隨時間變化
科目:高中化學 來源:2016-2017學年浙江省溫州市十校聯合體高二上期末化學試卷(解析版) 題型:實驗題
實驗室用下列方法測定某水樣中O2的含量。
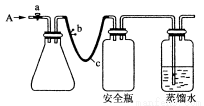
(1)用如上圖所示裝置,c是長橡膠管。使水中溶解的O2在堿性條件下將Mn2+氧化成MnO(OH)2,反應的離子方程式為______________________。
①打開止水夾a和b,從A處向裝置內鼓入過量N2,此操作的目的________________。
②用注射器抽取20.00mL某水樣從A處注入錐形瓶。
③再分別從A處注入含m mol NaOH的溶液及過量的MnSO4溶液。
④完成上述操作后,下面應進行的操作是___________。
A.微熱錐形瓶 B.夾緊止水夾a、b C.充分振蕩錐形瓶 D.繼續通入N2
(2)用I-將生成的MnO(OH)2再還原為Mn2+,反應的離子方程式為:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
⑤接著④操作后,分別從A處注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重復第④步操作。
(3)用Na2S2O3標準溶液滴定(2)中生成的I2,反應方程式為:I2+2Na2S2O3=2NaI+Na2S4O6
⑦取下錐形瓶,向其中加入2~3滴__________作指示劑。
⑧用 0.005mol·L-1 Na2S2O3滴定至終點,終點現象_______________________。
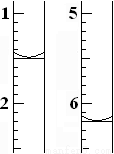
(4)滴定過程中,滴定前后滴定管中的液面讀數如圖所示。
⑨經計算,此水樣中氧(O2)的含量為(單位:mg·L-1)_______________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一上期末化學卷(解析版) 題型:選擇題
將相同質量的銅分別和過量濃硝酸、稀硝酸反應,下列敘述正確的是
A.反應速率:兩者相同
B.消耗硝酸的物質的量:前者多,后者少
C.反應生成氣體的顏色:前者淺,后者深
D.反應中轉移的電子總數:前者多,后者少
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:填空題
已知25 ℃時部分弱電解質的電離平衡常數數據如下表:
弱酸化學式 | HSCN | CH3COOH | HCN | H2CO3 |
電離平衡常數 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物質的量濃度的 A.CH3COONa、B.NaCN、C.Na2CO3、D.NaHCO3溶液的pH由大到小的順序為____________(填字母)。
(2)常溫下, 0.1 mol·L-1的CH3COOH 溶液加水稀釋,下列表達式的數據變大的是______。
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)·C(OH-)
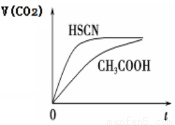
(3)25 ℃時,將 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分別與20mL 0.1 mol·L-1NaHCO3溶液混合,實驗測得產生的氣體體積(V)隨時間(t)的變化如右圖所示:反應初始階段兩種溶液產生CO2氣體的速率存在明顯差異的原因是____________; 反應結束后所得兩溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”)
(4)25 ℃時,在 CH3COOH 與 CH3COONa 的混合溶液中,若測得 pH=6,則溶液中c(CH3COO-)-c(Na+)=__________mol·L-1(填精確值), c(CH3COO-)/c(CH3COOH)=_________。
(5)用離子方程式表示Na2CO3溶液呈堿性的原因_____________________________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:選擇題
觀察下列幾個裝置示意圖,有關敘述正確的是( )

A.裝置①中陽極上析出紅色固體
B.裝置②的待鍍鐵制品應與電源正極相連
C.裝置③中外電路電子由a極沿導線流向b極
D.裝置④的離子交換膜允許陽離子、陰離子、水分子自由通過
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:選擇題
在通常條件下,下列各組物質的性質排列正確的是( )
A. Na、Mg、Al 的第一電離能逐漸增大 B. O、 F、 N 的電負性逐漸增大
C. S2﹣、 Cl﹣、 K+的半徑逐漸增大 D. 熱穩定性: HF>H2O>NH3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省樂山市高二上學期期末化學試卷(解析版) 題型:推斷題
元素X位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為1;元素Y基態原子的3p軌道上有5個電子;元素Z的原子最外層電子數是其內層電子數的3倍;元素W基態原子的核外電子共有16種運動狀態。
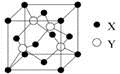
(1)①在元素周期表中,元素X位于 區,元素Y在周期表中的位置是 。
②Z所在周期中,第一電離能最大的元素是 (填元素名稱)。
③X+的核外電子排布式為 。
④Y和W兩元素最高價氧化物對應的水化物酸性較強的是 (填化學式)。
(2)X與Y所形成化合物晶體的晶胞如右圖所示。在1個晶胞中,X離子的數目為 ;該化合物的化學式為 。
(3)①在乙醇中的溶解度:Z的氫化物(H2Z)大于H2W,其主要原因是 。
②穩定性:H2Z H2W(填“>”、“<”或“=”),其主要原因是 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省樂山市高二上學期期末化學試卷(解析版) 題型:選擇題
在多電子原子中,決定軌道能量的是
A. 電子層 B. 電子層和能級
C. 電子層、能級和原子軌道空間分布 D. 原子軌道空間分布和電子自旋方向
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省廣安市高一上學期期末化學試卷(解析版) 題型:選擇題
下列對Na2O和Na2O2的敘述正確的是
A.都是白色固體 B.都是強氧化劑
C.與酸反應的生成物都是鹽和水 D.都能與水反應形成強堿溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com