
【題目】工業上從含鎳電鍍廢渣(除含鎳外,還含有Cu、Zn、Fe等雜質)中制備NiCO3的工藝流程如下。
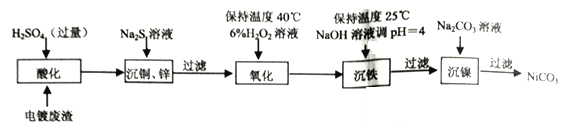
(1)“酸化”時需將電鍍廢渣粉碎并適當加熱,原因是________________________。
(2)“氧化”時需要控制溫度不超過40℃,其目的是________________________;“沉鐵”后所得濾液中c(Fe3+)=____________mol·L-1[該溫度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定條件下可生成黃鐵礬鈉[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如圖是pH-溫度關系圖,圖中陰影部分為黃鐵礬鈉穩定存在區域。

①FeOOH中鐵的化合價是____________價。.
②酸性條件下,ClO3ˉ恰好氧化Fe2+時,氧化劑與還原劑物質的量之比是____________。
③根據上圖,當T=120℃、pH=4時Fe元素的存在形式是____________(填化學式),該溫度下,若要制得黃鐵礬鈉需控制pH范圍____________(填字母選項)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能與水反應生成SO2和HCl。寫出NiCl2·6H2O在亞硫酰氯(SOCl2)中加熱脫水制無水NCl2的化學方程式____________________________________。NCl2·6H2O需在亞硫酰氯(SOCl2)中加熱脫水的原因是________________________。
【答案】 加快反應(或固體溶解)速率 防止H2O2分解 2.64×10-9 mol·L-1 +3 1︰6 Fe2O3 b NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑ 反應過程中產生的HCl能抑制NiCl2的水解
NiCl2+6SO2↑+12HCl↑ 反應過程中產生的HCl能抑制NiCl2的水解
【解析】試題(1)根據影響反應速率的因素分析;(2)加熱促進H2O2分解;“沉鐵”后所得濾液的PH=4,根據![]() 計算“沉鐵”后所得濾液中c(Fe3+);(3) ①根據化合價代數和等于0計算FeOOH中鐵的化合價;②ClO3ˉ被還原為Clˉ,Fe2+被氧化為Fe3+;③根據上圖,當T=120℃、pH=4時Fe元素的存在形式是Fe2O3;當T=120℃,PH=1~2.5時,Fe元素的存在形式是黃鐵礬鈉;(4)NiCl2·6H2O與SOCl2反應生成NiCl2、SO2、HCl;HCl能抑制NiCl2的水解;
計算“沉鐵”后所得濾液中c(Fe3+);(3) ①根據化合價代數和等于0計算FeOOH中鐵的化合價;②ClO3ˉ被還原為Clˉ,Fe2+被氧化為Fe3+;③根據上圖,當T=120℃、pH=4時Fe元素的存在形式是Fe2O3;當T=120℃,PH=1~2.5時,Fe元素的存在形式是黃鐵礬鈉;(4)NiCl2·6H2O與SOCl2反應生成NiCl2、SO2、HCl;HCl能抑制NiCl2的水解;
解析:(1)“酸化”時將電鍍廢渣粉碎并適當加熱,可以加快反應速率;(2) 加熱促進H2O2分解,“氧化”時控制溫度不超過40℃,可以防止H2O2分解;“沉鐵”后所得濾液的PH=4,根據![]() , c(Fe3+)=
, c(Fe3+)=![]() 2.64×10-9 mol·L-1;(3) ①根據化合價代數和等于0,FeOOH中鐵的化合價是+3;②ClO3ˉ被還原為Clˉ,Fe2+被氧化為Fe3+,根據得失電子守恒,氧化劑與還原劑物質的量之比是1︰6;③根據上圖,當T=120℃、pH=4時Fe元素的存在形式是Fe2O3;當T=120℃,PH=1~2.5時,Fe元素的存在形式是黃鐵礬鈉,所以控制PH為1~2.5,故選b;(4)NiCl2·6H2O與SOCl2反應生成NiCl2、SO2、HCl,反應方程式是NiCl2·6H2O+6SOCl2
2.64×10-9 mol·L-1;(3) ①根據化合價代數和等于0,FeOOH中鐵的化合價是+3;②ClO3ˉ被還原為Clˉ,Fe2+被氧化為Fe3+,根據得失電子守恒,氧化劑與還原劑物質的量之比是1︰6;③根據上圖,當T=120℃、pH=4時Fe元素的存在形式是Fe2O3;當T=120℃,PH=1~2.5時,Fe元素的存在形式是黃鐵礬鈉,所以控制PH為1~2.5,故選b;(4)NiCl2·6H2O與SOCl2反應生成NiCl2、SO2、HCl,反應方程式是NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑;反應過程中產生的HCl能抑制NiCl2的水解,所以NCl2·6H2O需在亞硫酰氯(SOCl2)中加熱脫水。
NiCl2+6SO2↑+12HCl↑;反應過程中產生的HCl能抑制NiCl2的水解,所以NCl2·6H2O需在亞硫酰氯(SOCl2)中加熱脫水。


科目:高中化學 來源: 題型:
【題目】反應“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化學鍍鎳。下列說法正確的是

A. P4分子中P原子均滿足8電子穩定結構
B. 反應中NaOH作還原劑
C. 該反應能自發進行,則ΔS<0
D. 反應中生成1 mol NaH2PO2,轉移電子數目為3×6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若下列圖像中橫軸代表所加溶液體積,縱坐標代表生成沉淀質量,則各項描述中與圖像能對應的是( )
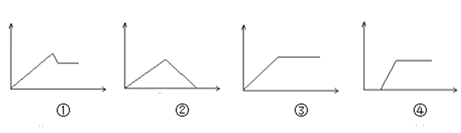
A. 圖①可能是MgCl2、AlCl3溶液逐滴加氨水至過量
B. 圖②可能是AlCl3溶液逐滴加NaOH溶液至過量
C. 圖③可能是NaAlO2溶液滴加稀鹽酸至過量
D. 圖④可能是含一定量HCl的AlCl3溶液逐滴加氨水至過量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示,請按要求回答下列問題

(1)打開K1,合并K2.A為___________(填“陰或陽")極,在該電極可觀察到的現象是__________;B極的電極反應為______________________;當有0.4mol電子轉移時,則析出銅的質量為____ g.
(2)打開K2,合并K1,A為_______(填“正”或“負)極,在該電極可觀察到的現象是___________;B極的電極反應為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用苯和1,2—二氯乙烷制聯芐的反應原理如下
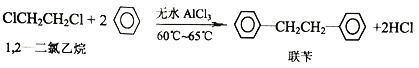
實驗室制取聯芐的裝置如圖所示(加熱和夾持儀器略去)
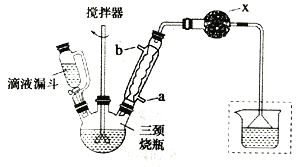
實驗步驟:
①在三頸燒瓶中加入120.0mL苯和適量無水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反應溫度在60~65℃,反應約60min。
②將反應后的混合物依次用2%Na2CO3溶液和水洗滌,在所得產物中加入少量無水MgSO4固體,靜置、過濾,蒸餾收集一定溫度下的餾分,得聯芐18.2g。
相關物理常數和物理性質如下表:
名稱 | 相對分子質量 | 密度/g·cm-3 | 熔點/℃ | 沸點/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 難溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 難溶于水,可溶于苯 |
聯芐 | 182 | 0.98 | 52 | 284 | 難溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的優點是_______________________;球形冷凝管進水口是____________(選填“a”或“b”)
(2)儀器X的名稱是________________;裝置中虛線部分的作用是____________。
(3)洗滌操作中,用2%Na2CO3溶液洗滌的目的是___________;水洗的目的是____________。
(4)在進行蒸餾操作時,應收集____________℃的餾分。
(5)該實驗中,聯芐的產率約為____________%(小數點后保留兩位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有濃度均為0.1mol/L的MgCl2溶液、氨水溶液,按體積比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列說法正確的是
A、混合前,氨水溶液中c(NH4+):c(OH—)=1:1
B、混合后c(NH4+):c(Cl—)=1:1
C、混合后c(Mg2+)×c(OH—)= 4.0×10—12
D、向混合后的分散系中加入FeCl3溶液,白色沉淀變紅褐色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①~⑨是幾種有機物的名稱或化學式:
①2,2,3﹣三甲基丁烷、②3﹣甲基﹣1﹣氯戊烷、③甲苯、④![]() 、 ⑤ClCH=CHCl、⑥
、 ⑤ClCH=CHCl、⑥![]() ⑦
⑦ ⑧
⑧ ⑨1,3,5﹣庚三烯
⑨1,3,5﹣庚三烯
據此回答下列問題:
(1)上述有機物中,互為同分異構體的是______(用編號表示),存在順反異構的是______(用編號表示).
(2)以③有機物為原料制備TNT炸藥的化學方程式為______.
(3)已知在有機物分子中,若某個碳原子上連接4個不同的原子或基團,則這種碳原子稱為“手性碳原子”,如 中帶*的C原子。[若同一個碳原子上連著2個碳碳雙鍵(如C═C═C)時,分子極不穩定,不存在。]⑨1,3,5﹣庚三烯的眾多鏈烴同分異構體中:含有“手性碳原子”,且與足量H2發生加成反應后仍具有“手性碳原子”的______種.含有“手性碳原子”,但與足量H2發生加成反應后,不具有“手性碳原子”的結構簡式是____.
中帶*的C原子。[若同一個碳原子上連著2個碳碳雙鍵(如C═C═C)時,分子極不穩定,不存在。]⑨1,3,5﹣庚三烯的眾多鏈烴同分異構體中:含有“手性碳原子”,且與足量H2發生加成反應后仍具有“手性碳原子”的______種.含有“手性碳原子”,但與足量H2發生加成反應后,不具有“手性碳原子”的結構簡式是____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1905年,德國人哈伯發明了工業合成氨技術,其反應方程式是N2(g)+3H2(g)![]() 2NH3(g) △H<0。下圖是合成氨反應平衡混合氣中NH3的體積分數隨溫度或壓強變化的曲線,圖中L(L1、L2)、X分別代表溫度或壓強。下列說法正確的是
2NH3(g) △H<0。下圖是合成氨反應平衡混合氣中NH3的體積分數隨溫度或壓強變化的曲線,圖中L(L1、L2)、X分別代表溫度或壓強。下列說法正確的是

A. L代表的是壓強,且L1>L2
B. L代表的是壓強,且L1<L2
C. L代表的是溫度,且L1<L2
D. L代表的是溫度,且L1>L2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象描述錯誤的是
編號 | 實驗 | 現象 |
A | 加熱放在坩堝中的小塊鈉 | 鈉先熔化成光亮的小球,燃燒時,火焰為黃色,燃燒后,生成淡黃色固體 |
B | 在酒精燈上加熱用砂紙打磨過的鋁箔 | 鋁箔變軟,失去光澤,熔化的鋁并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快變為灰綠色,最后變為紅褐色 |
D | 將水蒸氣通過灼熱的鐵粉 | 黑色粉末變為紅褐色 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com