
分析 ①混合物加水得無色透明溶液,則一定不含CuCl2;
②向上述溶液中加入過量BaCl2溶液有白色沉淀生成,沉淀為碳酸鋇或硫酸鋇,可含有Na2SO4、Na2CO3中的一種或都有,將沉淀濾出,并將濾液分成兩份;
③上述白色沉淀可部分溶于稀鹽酸,則說明沉淀既有碳酸鋇也有硫酸鋇,則溶液中一定含Na2SO4、Na2CO3,則一定不含CaCl2;
④往一份濾液中滴加氯水并加入苯,振蕩后靜置,層呈紫紅色,則含有KI,NaCl不能確定,以此解答該題.
解答 解:①混合物加水得無色透明溶液,則一定不含CuCl2;
②向上述溶液中加入過量BaCl2溶液有白色沉淀生成,沉淀為碳酸鋇或硫酸鋇,可含有Na2SO4、Na2CO3中的一種或都有,將沉淀濾出,并將濾液分成兩份;
③上述白色沉淀可部分溶于稀鹽酸,則說明沉淀既有碳酸鋇也有硫酸鋇,則溶液中一定含Na2SO4、Na2CO3,則一定不含CaCl2;
④往一份濾液中滴加氯水并加入苯,振蕩后靜置,層呈紫紅色,則含有KI,NaCl不能確定,
(1)由以上分析可知一定含有Na2CO3、Na2SO4、KI,一定不含CuCl2、CaCl2,可能含有NaCl,故答案為:Na2CO3、Na2SO4、KI;CuCl2、CaCl2; NaCl;
(2)沉淀含有碳酸鋇,與鹽酸反應生成氯化鋇、二氧化碳和水,反應的方程式為BaCO3+2HCl=BaCl2+CO2↑+H2O,故答案為:BaCO3+2HCl=BaCl2+CO2↑+H2O;
(3)氯氣可與碘化鉀反應生成碘,反應的離子方程式為Cl2+2I-=I2+2Cl-,故答案為:Cl2+2I-=I2+2Cl-.
點評 本題考查無機物的推斷和實驗的設計,為高頻考點,側重于學生的分析、實驗能力的考查,把握常見離子的檢驗方法及離子的顏色為解答的關鍵,注意檢驗中不能引入要檢驗的離子,題目難度不大.


 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:選擇題
| A. | 等于13.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
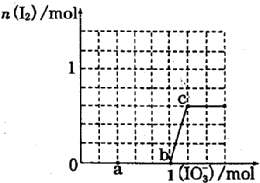 已知:還原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物質的量和和析出的I2的物質的量的關系曲線如圖.下列說法正確的是( )
已知:還原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物質的量和和析出的I2的物質的量的關系曲線如圖.下列說法正確的是( )| A. | 反應過程中的氧化產物均為Na2SO4 | |
| B. | a 點時消耗NaHSO3的物質的量為1.0mol | |
| C. | 0~b間的反應可用如下離子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 當溶液中I-與I2的物質的量之比為5:3時,加入的NaIO3為1.1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
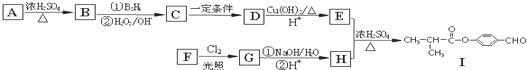
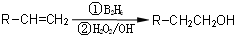
 .
. .
.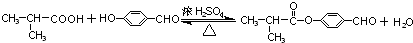 .
.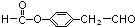 (鄰、間、對任寫一種即可).
(鄰、間、對任寫一種即可).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 僅有實驗①可推出肯定含有SO42-,不含Cl- | |
| B. | 該無色溶液肯定含有NH4+、K+、Al3+、SO42- | |
| C. | 該無色溶液中肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- | |
| D. | 不能確定該無色溶液是否含有K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由反應①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反應①②轉移的電子數不相同 | |
| C. | 若用標準狀況下4.48L CH4 還原NO2至N2,放出的熱量為173.4kJ | |
| D. | 若用標準狀況下4.48L CH4 還原NO2至N2,整個過程中轉移的電子總數為0.8mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com