
| A. | 分子式為C2H4O2的有機物不一定有酸性 | |
| B. | 當物質中的化學鍵發(fā)生斷裂時,一定發(fā)生化學變化 | |
| C. | 等質量的Al分別按a、b兩種途徑完全轉化,途徑a比途徑b產生的H2多 途徑a:Al$\stackrel{HCl}{→}$H2 途徑b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一種元素的陽離子與另一種元素的陰離子組成的物質不一定是純凈物 |
分析 A.該有機物為CH3COOH或HCOOCH3,若為HCOOCH3不具有酸性;
B.化學變化必須有新物質所處,而離子鍵在熔融狀態(tài)下一定斷裂及某些共價鍵在水溶液中的電離,都沒有新物質生成;
C.等質量的Al具有相同的物質的量,設物質的量為n,利用電子守恒計算出生成氫氣的量即可;
D.只由一種元素的陽離子與另一種元素的陰離子組成的物質,可能為混合物,如氯化鐵和氯化亞鐵的混合物.
解答 解:A.分子式為C2H4O2的有機物可能為CH3COOH或HCOOCH3,CH3COOH具有酸性,而HCOOCH3不具有酸性,故A正確;
B.離子鍵在熔融狀態(tài)下一定斷裂,如氯化鈉在熔融狀態(tài)下離子鍵斷裂,但不是化學變化;某些共價鍵在水溶液中可能斷裂,如HCl氣體溶于水后,共價鍵斷裂,但也不是化學變化,故B錯誤;
C.等質量的Al分別按a、b兩種途徑完全轉化,設Al的物質的量為nmol,根據(jù)電子守恒可知途徑a生成氫氣的物質的量為:$\frac{3nmol}{2}$=1.5nmol,途徑b生成Fe的物質的量為
nmol,nmolFe與鹽酸完全反應生成氫氣的物質的量為:$\frac{2nmol}{2}$=nmol,顯然途徑a比途徑b產生的H2多,故C正確;
D.純凈物是由一種物質構成的物質,只由一種元素的陽離子與另一種元素的陰離子組成的物質不一定為純凈物,如氯化鐵和氯化亞鐵的混合物,故D正確;
故選B.
點評 本題考查較為綜合,涉及化學實驗方案的評價、有機物結構與性質、純凈物與混合物等知識,題目難度中等,明確化學鍵變化與化學變化的關系為解答關鍵,D為易錯點,注意同種元素可以形成多種離子,試題培養(yǎng)了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| 裝置 | 操作 | 現(xiàn)象 |
 | 將盛有濃硝酸的燒杯A放入盛有淀粉KI溶液的燒杯C中,然后將銅片放入燒杯A后,立即用燒杯B罩住 | 燒杯A液體上方立即出現(xiàn)大量紅棕色氣體;一段時間后,紅棕色氣體消失,燒杯A和C中的液體都變成藍色 |
| A. | 燒杯A中發(fā)生反應:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 紅棕色氣體消失只與NO2和燒杯C中的KI發(fā)生反應有關 | |
| C. | 燒杯C中溶液變藍只與NO2和C中溶液發(fā)生反應有關 | |
| D. | 若將銅片換成鐵片,則C中的液體也可能變藍 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
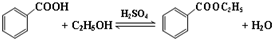
| 沸點(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 環(huán)己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 環(huán)己烷、乙醇和水共沸物 | 62.1 |

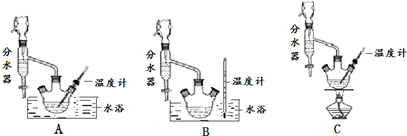
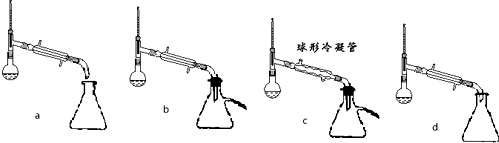
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com