
超細氮化鋁粉末被廣泛應用于大規模集成電路生產等領域。其制取原理為:
Al2O3+N2+3C![]() 2AlN+3CO↑
2AlN+3CO↑
由于反應不完全,氮化鋁產品中往往含有碳和氧化鋁雜質。為測定該產品中有關成分的含量,進行了以下兩個實驗:
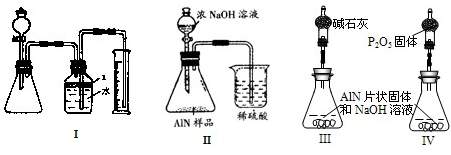
(1)稱取20.00 g樣品,將其加入過量的NaOH濃溶液中共熱并蒸干,AlN跟NaOH溶液反應生成NaAlO2,并放出氨氣6.72 L(標準狀況)。
①上述反應的化學方程式為_____________________________________________________;
②該產品中AlN的質量分數為_______________________________。
(2)另取10.00 g樣品置于反應器中,通入2.016 L(標準狀況)O2,在高溫下充分反應后測得氣體的密度為1.34 g·L-1(已折算成標準狀況,AlN不跟O2反應)。該產品中含雜質碳__________g。(此問需寫出計算過程)
(1)①AlN+NaOH+H2O====NaAlO2+NH3↑
②61.5%
(2)m(C)=1.92 g 計算過程見解析。
(2)O2+2C![]() 2CO O2+C
2CO O2+C![]() CO2
CO2
![]() (氣體)=1.34 g·L-1×22.4 L·mol-1=30.0 g·mol-1
(氣體)=1.34 g·L-1×22.4 L·mol-1=30.0 g·mol-1
28<30.0<44
即Mr(CO)<![]() (氣體)<Mr(CO2)
(氣體)<Mr(CO2)
故反應后得到的氣體是CO和CO2的混合氣體。
設混合氣體中CO2的物質的量為x,CO的物質的量為y。
2x+y=![]() ×2 (氧原子守恒)
×2 (氧原子守恒)
![]() =30.0 g·mol-1
=30.0 g·mol-1
解得:x=0.02 mol y=0.14 mol
所以:m(C)=12 g·mol-1×(0.02 mol+0.14 mol)=1.92 g


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
| 高溫 |
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| 高溫 |
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)稱取
①上述反應的化學方程式為_____________;?
②該樣品中的AlN的質量分數為___________。?
(2)另取
查看答案和解析>>
科目:高中化學 來源: 題型:
Al2O3+![]() 2AlN+3CO
2AlN+3CO
由于反應不完全,氮化鋁產品中往往含有炭和氧化鋁雜質,為測定該產品中有關成分的含量,進行了以下兩個實驗:
(1)稱取
①上述反應的化學方程式為___________________________________。
②該樣品中的AlN的質量分數為_______________。
③在裝置B中所選擇的試劑是________________(填序號)。
a.H2O b.濃H2SO
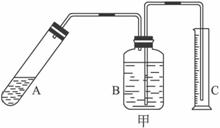
④上述實驗方案,可能因氣體體積測量不準,導致誤差較大。有人建議改用下列乙、丙兩個裝置中的一種(在通風櫥內進行),只需進行簡單而又必要的數據測定,可比較準確地確定樣品中AlN的質量分數。較合理的裝置是___________(填代號)。
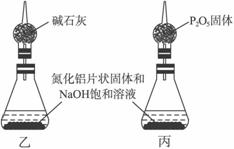
(2)另取
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com