
【題目】已知:PCl3的熔點為-112℃,沸點為75.5℃,遇水生成H3PO3和HCl;2PCl3+O2=2POCl3。某化學學習小組用裝置甲合成PCl3,并用裝置乙采取PCl3氧化法制備POCl3

(1)氯元素在周期表中的位置是_____________
(2)H3PO3中所含元素原子半徑由小到大的順序為_____________
(3)能比較出氯的非金屬性比磷的非金屬性強的是______________
A.HCl酸性比H3PO4的強 B.HCl穩定性比PH3的強
C.HClO4的酸性比H3PO3的強 D.PCl3中P顯正三價,C1顯負一價
(4)圖甲堿石灰的作用除了處理尾氣外還有防止_____________進入燒瓶,影響產品純度的作用
(5)圖乙A裝置中化學反應方程式是_____________
(6)POCl3水解的化學反應方程式為______________
(7)C中反應溫度控制在60~65℃,其原因是____________________________________________________
【答案】第三周期VIIA族 H<O<P BD 空氣中的水蒸氣 2H2O2 ![]() 2H2O+O2↑ POCl3+3H2O=H3PO4+3HCl 溫度過高,PCl3會大量揮發,導致產量降低;溫度過低,反應速率會變慢
2H2O+O2↑ POCl3+3H2O=H3PO4+3HCl 溫度過高,PCl3會大量揮發,導致產量降低;溫度過低,反應速率會變慢
【解析】
(1)氯是17號元素,原子核外有3個電子層,最外層有7個電子,故氯元素在周期表中的位置是第三周期VIIA族,故答案為:第三周期VIIA族。
(2)根據電子層數越多,原子的半徑越大,若電子層數相同,則隨著原子序數的增大,原子半徑越小,故H3PO3中所含元素原子半徑由小到大的順序為H<O<P,故答案為:H<O<P。
(3)A.不能通過氫化物的酸性比較非金屬性,故A錯誤;
B.元素的非金屬性越強,對應氫化物的穩定性越強,HCl穩定性比PH3的強,可說明氯元素的非金屬性比磷元素強,故B正確;
C.元素的非金屬性越強,對應最高價氧化物的水化物的酸性越強,H3PO3不是P元素的最高價含氧酸,不能作為判斷的依據,不能說明氯元素的非金屬性比磷元素強,故C錯誤;
D.PCl3中P顯正三價,C1顯負一價,說明氯對鍵合電子的吸引力更強,可說明氯元素的非金屬性比磷元素強,故D正確。
故答案為:BD。
(4)PCl3易水解生成H3PO3和HCl,加入堿石灰,除了處理尾氣外還有防止空氣中的水蒸氣進入燒瓶,故答案為:空氣中的水蒸氣。
(5)圖乙A裝置中H2O2在二氧化錳的催化作用下分解生成水和氧氣,化學方程式為:2H2O2![]() 2H2O+O2↑,故答案為:2H2O2
2H2O+O2↑,故答案為:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
(6)POCl3中P為+5價,可水解生成磷酸和鹽酸,反應的化學方程式為:POCl3+3H2O=H3PO4+3HCl,故答案為:POCl3+3H2O=H3PO4+3HCl。
(7)由題可知PCl3的熔點為-112℃,沸點為75.5℃,C中反應溫度控制在60~65℃,如果溫度過高,PCl3會大量揮發,從而導致產量降低;如果溫度過低,則反應速率會變慢,故答案為:溫度過高,PCl3會大量揮發,導致產量降低;溫度過低,反應速率會變慢。


科目:高中化學 來源: 題型:
【題目】給定條件下,下列選項中所示的物質間轉化均能一步實現的是( )
A. S![]() SO2
SO2![]() BaSO4
BaSO4
B. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3(aq)
Na2SiO3(aq)
C. MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
D. N2![]() NO2
NO2![]() HNO3
HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置中觀察到電流計指針偏轉,M棒變粗、N棒變細,以此判斷下表中所列M、N、P物質,其中可以成立的是

選項 | M | N | P |
A | 鋅 | 銅 | 稀硫酸溶液 |
B | 銅 | 鐵 | 稀鹽酸溶液 |
C | 銀 | 鋅 | 硝酸銀溶液 |
D | 鋅 | 鐵 | 硝酸鐵溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.鋁及其化合物用途非常廣泛,已知鉛(Pb)與硅同主族且Pb比Si多3個電子層。回答下列問題;
(1)硅位于元素周期表的第______周期______族。Pb比Si的原子半徑______(填“大”或“小”)
(2)難溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],發生的反應為PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,說明(CH3COO)2Pb是______(填“強”或“弱”)電解質。
(3)鉛蓄電池充放電原理為Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”為______(填“放電”或“充電”)。
2PbSO4+2H2O,其中工作“B”為______(填“放電”或“充電”)。
(4)將PbO2加入硝酸酸化的Mn(NO3)2溶液中攪拌后溶液顯紫紅色;則每反應1 mol Mn(NO3)2轉移____________mol電子。
Ⅱ.元素鉻(Cr)在自然界主要以+3價和+6價存在。工業上利用鉻鐵礦(FeO·Cr2O3)冶煉鉻的工藝流程如圖所示:

(1)水浸I要獲得浸出液的操作是______。
(2)常溫下Cr(OH)3的溶度積Ksp=1×10-32,若要使Cr3+完全沉淀,則pH為______[c(Cr3+)降至10-5 mol/L可認為完全沉淀]。
(3)以鉻酸鈉(Na2CrO4)為原料,用電化學法可制備重鉻酸鈉Na2Cr2O7),實驗裝置如圖所示(已知:2CrO42-+2H+=C2O72-+H2O)。
陽極的電極反應式為______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在混合導體透氧膜反應器中一步同時制備氨合成氣(N2、H2)和液體燃料合成氣(CO、H2),其工作原理如圖所示,下列說法錯誤的是
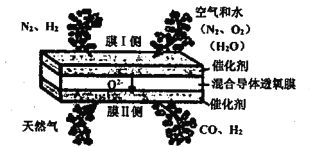
A. 膜I側反應為: H2O+2e-=H2+O2- O2+4e-=2O2-
B. 膜II側相當于原電池的負極
C. 膜II側發生的反應為:CH4+O2--2e-=2H2+CO
D. 膜II側每消耗1molCH4,膜I側一定生成1mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據實驗室制備氯氣的裝置(如下),回答下列問題;

(1)儀器A 和 B名稱___________ ;____________
(2)寫出B中發生反應的離子方程式_____________________________________
(3)裝置C的作用__________________________________________
(4)裝置D的作用________________________________________________
(5)檢驗E中氯氣已經收集滿的方法_________________________________________
(6)寫出F中發生的反應方程式______________________________________________
(7)每生成0.5mol氯氣轉移________________個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗與對應的解釋或結論正確的是( )
選項 | 實驗 | 解釋或結論 |
A |
2 mL 0.2mol L-1 H2C2O4(草酸)溶液 | 右側試管中溶液紫色褪去慢,推知反應物濃度越大,反應速率越小 |
B | 分別向盛有等量煤油、無水乙醇的兩燒杯中加入大小相等的金屬鈉,對比觀察現象 | 乙醇分子中羥基上的氫原子活潑 |
C | 分別向盛有動物油、石蠟的兩燒杯中加入足量燒堿溶液,充分加熱,冷卻 | 動物油、石蠟均能發生皂化反應 |
D | 將電石與食鹽水反應生成的氣體,通入酸性高錳酸鉀溶液中,觀察溶液顏色變化 | 由溶液紫色褪去可知乙炔能發生氧化反應 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三周期元素X、Y、Z、W的最高價氧化物溶于水可得四種溶液,0.01mol/L的這四種溶液pH與該元素原子半徑的關系如下圖所示。下列說法正確的是

A. 簡單離子半徑: X>Y>Z>W
B. W的單質在常溫下是黃綠色氣體
C. 氣態氫化物的穩定性: Z>W>Y
D. X和Y的最高價氧化物對應的水化物恰好中和時,溶液中的微粒共有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校科學興趣小組探究二氧化碳與過氧化鈉反應是否有氧氣生成,設計了如圖的實驗裝置.B中盛有飽和碳酸氫鈉溶液,目的是除去二氧化碳中混有的氯化氫氣體,E為收集氧氣裝置.

(1)寫出裝置A中發生反應的化學方程式____________。
(2)C中盛有____________,目的是_____________。
(3)寫出裝置D中發生反應的化學方程式__________。
(4)指出裝置E的錯誤_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com