
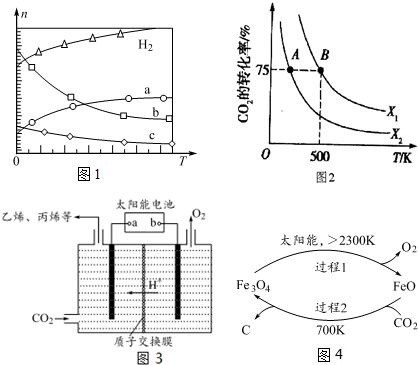
分析 (1)H2的標準燃燒熱的熱化學方程式為:①H2(g)+$\frac{1}{2}$O2?H2O(l)△H=-285.8kJ•mol-1;
CH2=CH2的標準燃燒熱的熱化學方程式為:②CH2=CH2(g)+3O2?2CO2(g)+2H2O(l)△H=-1411.0kJ•mol-1;
③H2O(g)?H2O(l)△H=-44kJ•mol-1;
根據蓋斯定律可知,①×6-②-③×4可得2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g);
(2)△H-T△S<0時反應自發進行;
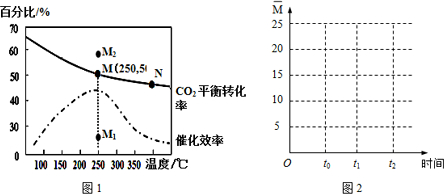
(3)由圖可知,250℃時CO2的平衡轉化率為50%,利用三段式求出平衡時的濃度,再根據平衡常數表達式計算;
(4)a.該反應正方向為放熱反應,升高溫度逆向移動;
b.溫度越高,反應物活化分子百分數越大;
c.根據圖象分析;
d.增大H2的量,CO2的平衡轉化率增大;
e.混合氣體的質量不變,體積不變,所以混合氣體的密度始終不變;
(5)反應前混合氣體的平均相對分子質量=$\frac{44×2+2×6}{2+6}$=12.5,隨著反應進行,氣體的物質的量減小,混合氣體的平均相對分子質量增大,至t0時達到化學平衡,t1時將容器體積瞬間擴大至2V L,平衡向逆方向移動,t2時重新達平衡.
解答 解:(1)H2的標準燃燒熱的熱化學方程式為:①H2(g)+$\frac{1}{2}$O2?H2O(l)△H=-285.8kJ•mol-1 ;
CH2=CH2的標準燃燒熱的熱化學方程式為:②CH2=CH2(g)+3O2?2CO2(g)+2H2O(l)△H=-1411.0kJ•mol-1;
③H2O(g)?H2O(l)△H=-44kJ•mol-1;
根據蓋斯定律可知,①×6-②-③×4可得2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)
△H=6(-285.8kJ•mol-1 )-(-1411.0kJ•mol-1)-4(-44kJ•mol-1)=-127.8kJ/mol;
故答案為:-127.8;
(2)由CO2合成CH2=CH2的反應,2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H=-127.8kJ/mol,該反應△H<0,△S<0,△H-T△S<0時反應自發進行,所以低溫下反應自發進行;
故答案為:低溫;該反應的△H<0,△S<0;
(3)由圖可知,250℃時CO2的平衡轉化率為50%,則
2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)
起始濃度(mol/L):1 3 0 0
轉化濃度(mol/L):0.5 1.5 0.25 1.0
平衡濃度(mol/L):0.5 1.5 0.25 1.0
平衡常數K=$\frac{1.{0}^{4}×0.25}{0.{5}^{2}×1.{5}^{6}}$=0.088;
故答案為:0.088;
(4)a.該反應正方向為放熱反應,升高溫度逆向移動,N點的溫度大于M點,所以M點反應向正方向進行的程度大,即平衡常數大小:M>N,故a正確;
b.溫度越高,反應物活化分子百分數越大,N點的溫度高,所以反應物活化分子百分數大小:M<N,故b錯誤;
c.由圖象可知,其他條件不變,若不使用催化劑,則250℃時CO2的平衡轉化率可能位于點M,故c錯誤;
d.增大H2的量,CO2的平衡轉化率增大,所以其他條件不變,若投料改為4mol H2和1mol CO2時,則250℃時CO2的平衡轉化率可能位于點M2,故d正確;
e.混合氣體的質量不變,體積不變,所以混合氣體的密度始終不變,所以不能根據混合氣體的密度來判斷化學反應是否達到平衡狀態,故e錯誤;
故答案為:a、d;
(5)反應前混合氣體的平均相對分子質量=$\frac{44×2+2×6}{2+6}$=12.5,所以起點坐標為(0,12.5),隨著反應進行,氣體的物質的量減小,混合氣體的平均相對分子質量增大,至t0時達到化學平衡,若全部轉化為CH2=CH2和H2O平均相對分子質量=$\frac{28+18×4}{1+4}$=20,則t0達平衡時$\overline{M}$應在區間(12.5,20),t1時將容器體積瞬間擴大至2V L,平衡向逆方向移動,t2時重新達平衡,平均相對分子質量減小,t2達平衡時 $\overline{M}$應大于12.5,所以圖象為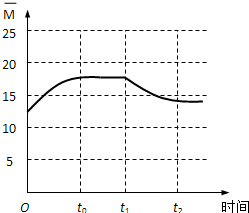 ,
,
故答案為: .
.
點評 本題考查本題考查了蓋斯定律、化學平衡移動的影響因素、化學平衡計算等,注意把握蓋斯定律的應用方法、三段式在化學平衡計算中的靈活應用是解題的關鍵,側重于考查學生對基礎知識的綜合應用能力、計算能力和畫圖能力,題目難點中等.


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:選擇題
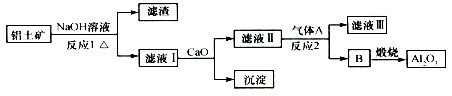
| A. | 氣體A一定為HCl | B. | 濾液Ⅰ中溶質可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸鈣 | D. | 反應1、反應2均是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該硫酸試劑的物質的量濃度為18.4 | |
| B. | 該硫酸與等體積的水混合所得溶液的質量分數小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取該硫酸12.5mL | |
| D. | 2.4gMg與足量的該硫酸反應得到H2 的體積為2.24L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化學鍵形成時要釋放出的能量/kJ | 436 | 946 | a |
| A. | 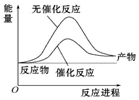 如圖可表示合成氨過程中的能量變化 | |
| B. | a的數值為391 | |
| C. | Q1的數值為92 | |
| D. | 相同條件下,反應物若為2 mol N2和6 mol H2,放出熱量Q2>2Q1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
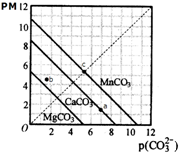
| A. | a點可表示CaCO3的飽和溶液,且c(Ca2+)<c(CO32-) | |
| B. | b點可表示MgCO3的不飽和溶液,且c(Mg2+)>c(CO32-) | |
| C. | c可表示MnCO3的飽和溶液,且c(Mn2+)=c(CO32-) | |
| D. | MgCO3、CaCO3、MnCO3的Ksp依次增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始濃度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡濃度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min內,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高溫度,反應的平衡常數減小,則平衡時PCl3的轉化率變大 | |
| C. | 當容器中Cl2為1.2 mol時,反應達到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同條件下再達平衡時,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com