

分析 (1)甲裝置電解飽和食鹽水,左側碳棒連接電源負極,為陰極,右側碳棒連接電源正極,為陽極,溶液中氯離子在陽極上失電子生成氯氣,氫離子在陰極得到電子生成氫氣,陰極附近氫氧根離子濃度增大,遇到酚酞溶液變紅色;
(2)甲裝置中B口導出的氣體為氯氣,用氫氧化鈉溶液吸收氯氣,反應生成氯化鈉、次氯酸鈉與水;
(3)①利用甲、丙裝置測定飽和食鹽水的電解率,方法Ⅱ通過測定丙裝置中除硬質玻璃管外的某裝置前后質量差來計算飽和食鹽水的電解率,是利用U形管測定氫氣還原氧化銅過程中生成的水蒸氣,要防止外界空氣中的水蒸氣等被U形管中堿石灰吸收;
②乙方案的方法Ⅰ、Ⅱ測得的實驗結論都不正確,主要是氫氣還原氧化銅過程中不能全部發生反應,造成誤差;
(4)根據溶液pH計算氫氧根離子濃度,結合化學方程式計算反應的氯化鈉質量,利用溶解度計算150ml溶液中氯化鈉的質量,用反應的氯化鈉質量除以原溶液中氯化鈉質量得到食鹽水的電解率.
解答 解:(1)甲裝置電解飽和食鹽水,左側碳棒連接電源負極,為陰極,右側碳棒連接電源正極,為陽極,溶液中氯離子在陽極上失電子生成氯氣,氫離子在陰極得到電子生成氫氣,陰極附近氫氧根離子濃度增大,遇到酚酞溶液變紅色,電解過程中甲裝置中的實驗現象為:左右碳棒上都有氣泡產生,左邊碳棒附近溶液變紅,
故答案為:左右碳棒上都有氣泡產生,左邊碳棒附近溶液變紅;
(2)甲裝置中B口導出的氣體為氯氣,用氫氧化鈉溶液吸收氯氣,則裝置B連C,反應生成氯化鈉、次氯酸鈉與水,離子方程式為Cl2+2OH-=H2O+Cl-+ClO-,
故答案為:B;C;Cl2+2OH-=H2O+Cl-+ClO-;
(3)①利用甲、丙裝置測定飽和食鹽水的電解率,方法Ⅱ通過測定丙裝置中除硬質玻璃管外的某裝置前后質量差來計算飽和食鹽水的電解率,是利用U形管測定氫氣還原氧化銅過程中生成的水蒸氣,在乙方案方法Ⅱ中的裝置中添加一干燥裝置防止外界空氣中的水蒸氣的干擾,應連接裝置D處,
故答案為:D;
②乙方案的方法Ⅰ、Ⅱ測得的實驗結論都不正確,主要是氫氣還原氧化銅過程中不能全部發生反應,造成誤差,
故答案為:同意,在乙方案中氫氣還原氧化銅,氫氣不能全部反應,誤差太大;
(4)若電解150mL飽和食鹽水一段時間,測得溶液的為pH為14,則c(H+)=10-14mol/L,c(OH-)=1mol/L,氫氧根離子物質的量=0.15L×1mol/L=0.15mol,由2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,電解的氯化鈉物質的量為0.15mol,其質量=0.15mol×58.5g/mol=8.775g,飽和食鹽水密度約為1.33g/mL,150mL飽和食鹽水質量=1.33g/mL×150ml=199.5g,溶液中含有溶質氯化鈉質量=199.5g×$\frac{36}{100+36}$=52.81g,電解率=$\frac{8.775g}{52.81g}$×100%=16.6%,
故答案為:16.6%.
點評 本題考查電解原理應用、定量測定實驗、對裝置的分析評價等,關鍵是對實驗原理的理解,側重考查學生對基礎知識的遷移應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 用潤濕的pH試紙測稀堿溶液的pH,測定值偏小 | |
| B. | 用容量瓶配制溶液,定容時俯視刻度線,所配溶液濃度偏小 | |
| C. | 中和熱測定實驗中,用溫度計測定鹽酸溫度后,未用水沖洗就直接再次使所測△H偏高 | |
| D. | 測定中和反應的反應熱時,將堿緩慢倒入酸中,所測溫度值偏小 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 16O2、18O2互為同位素 | B. | H2O、D2O、T2O的化學性質不同 | ||
| C. | 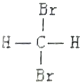 和 和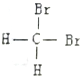 是兩種不同結構 是兩種不同結構 | D. | 白磷與紅磷互為同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.4g金屬鎂變成鎂離子時失去的電子數目為0.1NA | |
| B. | 2g氫氣所含原子數目為NA | |
| C. | 1mol Al3+含有核外電子數為3NA | |
| D. | 17g氨氣所含電子數目為10NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 該反應是置換反應 | |
| B. | Cl2是氧化劑 | |
| C. | Fe(OH)3發生還原反應 | |
| D. | 每生成1mol K2FeO4轉移電子的物質的量為3mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0℃,1.01×105Pa時,22.4L空氣中所含的N2、O2分子總數為5NA | |
| B. | 100mL 0.1mol/L的硝酸鈣溶液中鈣離子的數目為0.02NA | |
| C. | 6.5g Zn由原子變為離子時失去的電子數目為0.2NA | |
| D. | 0.012kg的${\;}_{6}^{14}$C中的碳原子數目等于NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com