
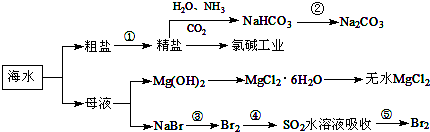
| A. | 要實現反應②可向NaHCO3溶液中加入過量石灰水 | |
| B. | 氯堿工業中采用陰離子交換膜提高產品純度 | |
| C. | MgCl2溶液加熱蒸干可得無水MgCl2 | |
| D. | 溴元素在反應③、⑤中均被氧化,在反應④中被還原 |
分析 A.要實現反應②可向NaHCO3溶液中加入過量石灰水,NaHCO3和Na2CO3都與澄清石灰水反應生成沉淀;
B.氯堿工業是電解飽和食鹽水,溶液中陽極上氫離子和陰極上氯離子放電,在陰極產生氫氧化鈉,為防止氯氣與氫氧化鈉反應采用陽離子交換膜,使鈉離子轉移到陰極,所以提高產品純度;
C.MgCl2溶液加熱,鎂離子水解生成氫氧化鎂和氯化氫,氯化氫易揮發,使水解可以完全;
D.根據物質的性質及變化結合元素化合價的變化判斷.
解答 解:A.要實現反應②可向NaHCO3溶液中加入過量石灰水,NaHCO3和Na2CO3都與澄清石灰水反應生成沉淀,不能得到碳酸鈉,可以加熱分解得到,故A錯誤;
B.氯堿工業是電解飽和食鹽水,溶液中陽極上氫離子和陰極上氯離子放電,在陰極產生氫氧化鈉,為防止氯氣與氫氧化鈉反應采用陽離子交換膜,使鈉離子轉移到陰極,所以提高產品純度,故B錯誤;
C.MgCl2溶液加熱,鎂離子水解生成氫氧化鎂和氯化氫,氯化氫易揮發,使水解可以完全,故C錯誤;
D.海水提溴是先通入足量氯氣氧化溴離子為溴單質,然后將溴單質還原為溴化氫,再通入適量氯氣氧化溴離子為溴單質,④中溴得電子化合價降低,所以溴元素被還原,故D正確;
故選D.
點評 本題重點考查了化學與資源綜合利用、環境保護等方面的知識,開發利用金屬礦物和海水資源是新課程標準教材中的必修內容,在高考命題上也有所體現.海水資源相關的海水提溴、海水提鎂都是高考命題的熱點,同學們應給予重視.只在掌握好相關的物理、化學性質以及基本實驗技能就能順利解答,題目難度中等.


 新思維假期作業暑假吉林大學出版社系列答案
新思維假期作業暑假吉林大學出版社系列答案 藍天教育暑假優化學習系列答案
藍天教育暑假優化學習系列答案科目:高中化學 來源: 題型:選擇題
| A. | H+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Fe3+、NH4+、SCN-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 濃硫酸 NaCl+MnO2 AgNO3 | B. | NaOH溶液 Ca(HCO3)2 Ca(OH)2 | ||
| C. | NaOH溶液 (NH4)2SO4 KAl(SO4)2 | D. | 濃硫酸 NaCl H2S |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
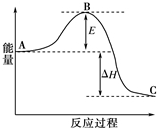 合成氨反應N2(g)+3H2(g)?2NH3(g),反應過程的能量變化如圖所示.已知N2(g)與H2(g)反應生成17g NH3(g),放出46.1kJ的熱量.
合成氨反應N2(g)+3H2(g)?2NH3(g),反應過程的能量變化如圖所示.已知N2(g)與H2(g)反應生成17g NH3(g),放出46.1kJ的熱量.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  表示0.001 mol•L一1鹽酸滴定0.001 mol•L一1NaOH溶液的滴定曲線 | |
| B. | 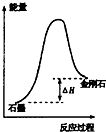 所示,石墨的熔點比金剛石低 | |
| C. | 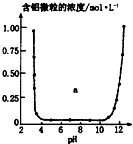 表示的是Al3+與OH一反應時含鋁微粒濃度變化曲線,圖中a區域的物質是Al(OH)3 | |
| D. | 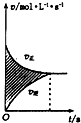 所示,圖中的陰影部分面積的含義是[v(正)-v(逆))] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨水導電能力比BaSO4的水溶液強,所以氨水是強電解質,BaSO4是弱電解質 | |
| B. | 已知H2C2O4是弱酸,其電離方程式為:H2C2O4?2H++C2O42- | |
| C. | 若反應C(s)+CO2(g)?2CO(g)在常溫下不能自發,則該反應的△H>0 | |
| D. | 工業合成氨溫度控制在500℃,目的是為了提高產率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
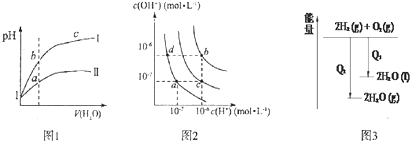
| A. | 圖l表示同溫度下,pH=1的鹽酸和醋酸溶液分別加水稀釋時pH的變化曲線,其中曲線Ⅱ為鹽酸,且b點溶液的導電性比a點強 | |
| B. | 圖2中純水僅升高溫度,就可以從a點變到c點 | |
| C. | 圖2中在b點對應溫度下,將pH=2的H2SO4與pH=10的NaOH溶液等體積混合后,溶液顯中性 | |
| D. | 圖3表示氫氣與氧氣反應中的能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | Na+ | Fe2+ | Cl- | SO42- |
| 濃度(mol/L) | 3.0×10-4 | 2.0×10-4 | 2.5×10-4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com