
【題目】探索氮氧化合物反應的特征及機理,對處理該類化合物的污染問題具有重要意義。回答下列問題:
(1)工業上利用Na2CO3溶液吸收NO、NO2混合氣制備NaNO2,該反應可實現NO和NO2的完全轉化,反應的化學方程式為________。
(2)NO2可發生二聚反應生成N2O4,化學方程式為![]() ,上述反應達到平衡后,升高溫度可使體系顏色加深,則該反應的
,上述反應達到平衡后,升高溫度可使體系顏色加深,則該反應的![]() ________0(填>或<)。已知該反應的正反應速率方程為υ正= k正·c2(NO2),逆反應速率方程為υ逆=k逆·c(N2O4),其中k正、k逆分別為正、逆反應的速率常數。則圖(lgk表示速率常數的對數;
________0(填>或<)。已知該反應的正反應速率方程為υ正= k正·c2(NO2),逆反應速率方程為υ逆=k逆·c(N2O4),其中k正、k逆分別為正、逆反應的速率常數。則圖(lgk表示速率常數的對數; ![]() 表示溫度的倒數)所示①、②、③、④四條斜線中,能表示lgk正隨變化關系的是斜線________,能表示lgk逆隨
表示溫度的倒數)所示①、②、③、④四條斜線中,能表示lgk正隨變化關系的是斜線________,能表示lgk逆隨![]() 變化關系的是斜線________。
變化關系的是斜線________。
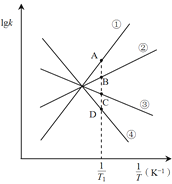
(3)圖中A、B、C、D點的縱坐標分別為a + 1.5、a+0.5、a-0.5、a-1.5,則溫度T1時化學平衡常數K=_______mol-1·L。已知溫度T1時,某時刻恒容密閉容器中NO2、N2O4濃度均為0.2 mol·L-1,此時υ正________υ逆(填>或<);上述反應達到平衡后,繼續通入一定量的NO2,則NO2的平衡轉化率將________,NO2的平衡濃度將________(填增大、減小或不變)。
【答案】NO + NO2 + Na2CO3=2NaNO2 + CO2 < ③ ④ 10 > 增大 增大
【解析】
(1)Na2CO3溶液和NO、NO2反應生成NaNO2,再寫出化學方程式;
(2)升高溫度體系顏色加深,平衡逆移,則正反應為放熱反應;化學反應速率和溫度成正比,隨著溫度下降 ![]() 增大,正逆反應速率下降,則lgk正和lgk逆均減小,由于溫度下降平衡正移,υ正>υ逆,則下降相同溫度時lgk逆減小更快,以此分析;
增大,正逆反應速率下降,則lgk正和lgk逆均減小,由于溫度下降平衡正移,υ正>υ逆,則下降相同溫度時lgk逆減小更快,以此分析;
(3)化學平衡常數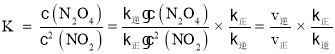 ,平衡時υ正=υ逆再利用C點和D點數據求得k逆和k正;比較濃度商Q與K值得大小,若Q>K則平衡逆移,若Q<K則平衡正移,若Q=K則達到平衡;上述反應達到平衡后,繼續通入一定量的NO2,等效于達到平衡后加壓,平衡正移;根據勒夏特列原理,達到平衡時濃度比起始時大。
,平衡時υ正=υ逆再利用C點和D點數據求得k逆和k正;比較濃度商Q與K值得大小,若Q>K則平衡逆移,若Q<K則平衡正移,若Q=K則達到平衡;上述反應達到平衡后,繼續通入一定量的NO2,等效于達到平衡后加壓,平衡正移;根據勒夏特列原理,達到平衡時濃度比起始時大。
(1)Na2CO3溶液和NO、NO2反應生成NaNO2,根據元素守恒化學方程式為:![]() ,故答案為:
,故答案為:![]() ;
;
(2)升高溫度體系顏色加深,平衡逆移,則正反應為放熱反應![]() <0;化學反應速率和溫度成正比,隨著溫度下降
<0;化學反應速率和溫度成正比,隨著溫度下降 ![]() 增大,正逆反應速率下降,則lgk正和lgk逆均減小,由于溫度下降平衡正移,υ正>υ逆,則下降相同溫度時lgk逆減小更快,則③表示lgk正隨
增大,正逆反應速率下降,則lgk正和lgk逆均減小,由于溫度下降平衡正移,υ正>υ逆,則下降相同溫度時lgk逆減小更快,則③表示lgk正隨![]() 變化關系的是斜線,④表示lgk逆隨
變化關系的是斜線,④表示lgk逆隨![]() 變化關系的是斜線,故答案為:<;③;④;
變化關系的是斜線,故答案為:<;③;④;
(3)化學平衡常數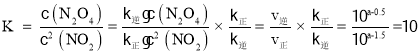 ;NO2、N2O4濃度均為0.2 mol·L-1,則濃度商
;NO2、N2O4濃度均為0.2 mol·L-1,則濃度商![]() <K,則平衡正移,υ正>υ逆;上述反應達到平衡后,繼續通入一定量的NO2,等效于達到平衡后加壓,平衡正移;根據勒夏特列原理,達到平衡時濃度比起始時大,故答案為:10;>;增大;增大。
<K,則平衡正移,υ正>υ逆;上述反應達到平衡后,繼續通入一定量的NO2,等效于達到平衡后加壓,平衡正移;根據勒夏特列原理,達到平衡時濃度比起始時大,故答案為:10;>;增大;增大。


科目:高中化學 來源: 題型:
【題目】實驗室用燃燒法測定某種氨基酸(CxHyOzNm)的分子組成。取Wg該種氨基酸放在純氧中充分燃燒,生成二氧化碳、水和氮氣。按下圖所示裝置進行實驗。

回答下列問題:
(1)實驗開始時,首先通入一段時間的氧氣,其理由是__________________。
(2)以上裝置中需要加熱的儀器有_______ (填寫字母),操作時應先點燃_____處的酒精燈。
(3)A裝置中發生反應的化學方程式是____________________________。
(4)D裝置的作用是____________________________。
(5)讀取氮氣的體積時,應注意①_________________;②_________________。
(6)實驗中測得氮氣的體積為VmL(標準狀況),為確定此氨基酸的分子式,還需要的有關數據有____________________。
A.生成二氧化碳氣體的質量
B.生成水的質量
C.通人氧氣的體積
D.氨基酸的相對分子質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NA為阿伏伽德羅常數的值。下列說法不正確的是( )
A. 12g金剛石中平均含有2NA個σ鍵
B. 1mol SiO2晶體中平均含有4NA個σ鍵
C. 12g石墨中平均含1.5NA個σ鍵
D. 1mol CH4中含4NA個s﹣p σ鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨基甲酸銨發生分解的化學方程式為NH2COONH4(s)![]() 2NH3(g) + CO2(g)。利用如下裝置測定不同溫度下該反應以分壓表示的化學平衡常數Kp,實驗步驟如下:
2NH3(g) + CO2(g)。利用如下裝置測定不同溫度下該反應以分壓表示的化學平衡常數Kp,實驗步驟如下:
(Ⅰ)關閉K3,打開K1和K2,開啟真空泵抽氣至測壓儀數值穩定后關閉K1;
(Ⅱ)關閉K2,緩慢開啟K3至U型管兩邊液面相平并保持不變,讀取壓強數值。記錄25℃、30℃下壓強分別為12.0 kPa、17.1 kPa。下列說法錯誤的是
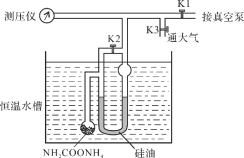
A.氨基甲酸銨分解反應的ΔH>0
B.該反應25℃時的化學平衡常數Kp = 2.56×1011 Pa3
C.步驟Ⅰ中測壓儀數值未穩定即關閉K1,Kp測量值偏小
D.步驟Ⅱ中讀數時U型管左側液面偏高,Kp測量值偏小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023個NH3分子。則
A. 體積:②>③>④>① B. 密度:②>③>①>④
C. 質量:②>③>④>① D. H原子個數:①>③>④>②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據所給出的裝置圖回答下列問題:
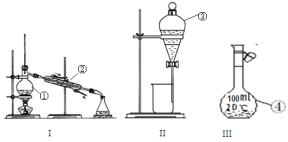
(1)①~④中,使用前必須檢查是否漏水的是____________(填儀器序號)。
(2)分離溴水中的溴應先選擇裝置_____(填Ⅰ、Ⅱ、Ⅲ或Ⅳ序號,下同),進行操作A_______(填操作名稱,下同);再選裝置_____,進行操作B________;操作A需在溴水中加一種試劑,選擇這一試劑時,下列性質你認為哪些是必需的:_______(填字母)。
A. 常溫下為液態 B. Br2在其中溶解程度小 C. 與水互不相溶
D. 密度比水大 E. 與Br2不反應 F. 溶解Br2后呈現橙紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將13.0 g鋅投入250mL某濃度的鹽酸中,鋅和鹽酸恰好完全反應。求:
(1)反應中生成的H2在標準狀況下的體積。__
(2)所用鹽酸中HCl的物質的量濃度。_____________
(3)需用多少體積的36.5%的濃鹽酸(ρ =1.20 g/mL)來配置上述鹽酸。_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應中的能量變化是由化學反應中舊化學鍵斷裂時吸收的能量與新化學鍵形成時放出的能量不同引起的.下圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化,下列說法正確的是
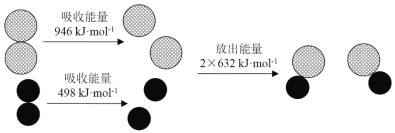
A. 1 mol N2(g)和NA個O2(g)反應放出的能量為180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有總能量小于2 mol NO(g)具有的總能量
C. 通常情況下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸熱反應一定需要加熱才能發生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去粗鹽中的Ca2+、Mg2+、SO42- 以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):
![]()
(1)判斷BaCl2已過量的方法是_______________________________________________。
(2)第④步中,相關的離子方程式是___________________________________________。
(3)若先用鹽酸再過濾,將對實驗結果產生影響,其原因是______________________________。
(4)為檢驗精鹽純度,需配制150 mL 0.2 mol/L NaCl(精鹽)溶液,下圖是該同學轉移溶液的示意圖,其中的錯誤是____________________________________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com