
| A、開發太陽能、水能、風能等新能源、減少使用煤、石油等化石燃料 | B、陶瓷、玻璃、水泥等是使用量最大的無機非金屬材料 | C、氫氧燃料電池、鉛蓄電池、硅太陽能電池中都利用了原電池原理 | D、Fe2O3俗稱鐵紅,常用作紅色油漆和涂料 |


 作業輔導系列答案
作業輔導系列答案 同步學典一課多練系列答案
同步學典一課多練系列答案 經典密卷系列答案
經典密卷系列答案 金牌課堂練系列答案
金牌課堂練系列答案科目:高中化學 來源: 題型:閱讀理解

| ||
| 高溫 |
| ||
| 高溫 |
| 4 |
| 7 |
| ||
| 高溫 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化學 來源:2015屆河南省焦作市高一下學期期末測試化學試卷(解析版) 題型:推斷題
由五種短周期主族元素組成的單質及化合物(或其溶液),它們的轉化關系如下圖所示。其中,A、B、C、D、E為單質,常溫下A為固體,B、C、D、E為氣體;G的焰色反應為黃色;D和E的反應在工農業生產中有重要的意義;K為G和I反應的產物之一。

(1)寫出五種單質的名稱
(2)I、J相遇反應生成H,反應的現象是 ,化學反應方程式為 ,H物質的電子式為
(3)F的顏色為 ,F和K反應的化學方程式為 。
(4)G和H也可以發生反應,若G和H恰好完全反應,則A、B、C、D、E的物質的量之比為 。
(5)D和E的反應是典型的可逆反應,并且是放熱反應。該反應的化學方程式為
請用某兩種物質的反應速率間的等量關系表明該反應已經達到化學平衡,該等量關系可以是 ;反應物的總能量E反與生成物的總能量E生的大小關系是:E反 E生。
查看答案和解析>>
科目:高中化學 來源:浙江省模擬題 題型:填空題
 2SO3(g),混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題
2SO3(g),混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題 
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,平衡________移動(填“向左”“向右”或“不移動”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,平衡________移動(填“向左”“向右”或“不移動”)  _____
_____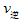 (填“>”“<”或“=”)
(填“>”“<”或“=”)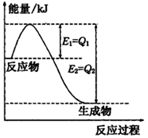

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義
(1)硫酸生產中,SO2催化氧化生成SO3;
 2SO2(g)+O2(g)
2SO2(g)+O2(g)![]() 2SO3(g),混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題,
2SO3(g),混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題,
①2SO2(g)+O2(g)![]() 2SO3(g)的△H 0(填“>”或“<”):若在恒溫、恒壓條件下向上述平衡體系中通人氦氣,平衡 移動(填“向左” 或“向右”)
2SO3(g)的△H 0(填“>”或“<”):若在恒溫、恒壓條件下向上述平衡體系中通人氦氣,平衡 移動(填“向左” 或“向右”)
②若溫度為T1、T2,反應的平衡常數分別為K1,K2,則K1 K2;反應進行到狀態D時,![]()
![]() (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,
①如圖是一定的溫度和壓強下N2和H2反應生成lmolNH3過程中能量變化示意圖,請寫出工業合成氨的熱化學方程式:
(△H的數值用含字母Q1、Q2的代數式表示)
②氨氣溶于水得到氨水,在25℃下,將a mol·L-1的氨水與b mol·L-1的鹽酸等體積混合,反應后溶液顯中性,則c(NH4+) c(Cl-)(填“>”、“<”或“=“);用含a和b的代數式表示出該混合溶液中氨水的電離平衡常數 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合態存在。已知25℃時KSP(AgCl)=1.6×l0-10 mol2·L-2 KSP(AgI)=1.5×l0-16 mol2·L-2 。在25℃下,向0.1L 0.002mol·L-l的NaCl溶液中加入0.1L 0.002mol·L-l硝酸銀溶液,有白色沉淀生成,從沉淀溶解平衡的角度解釋產生沉淀的原因是 ,向反應后的濁液中繼續加入0.1L0.002mol·L-1的NaI溶液,看到的現象是 ,產生該現象的原因是(用離子方程式表示) 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com