
| A. | 反應2Mg(s)+CO2(g)=C(s)+2MgO(s)能自發進行,則該反應的△H<0 | |
| B. | 為處理銀器表面的黑斑(Ag2S),將銀器浸于鋁質容器里的食鹽水中并與鋁接觸 | |
| C. | 常溫下,將稀CH3COONa溶液加水稀釋后,溶液中n(H+)•n(OH-)不變 | |
| D. | 在盛有Ca(OH)2懸濁液的絕熱密閉容器中,加入少量的CaO粉末后,溶液中Ca2+數目不變,pH降低 |
分析 A.如果△G=△H-T△S<0,則該反應能自發進行;
B.Ag、Al和食鹽水構成原電池,正極上硫化銀得電子發生還原反應;
C.常溫下,將醋酸鈉稀釋后濃度降低,醋酸根離子水解程度增大,則溶液中c(OH-)減小,溫度不變,離子積常數不變;
D.CaO和水反應生成氫氧化鈣且放出熱量,放出的熱量導致溶液溫度升高,降低氫氧化鈣溶解度.
解答 解:A.如果△G=△H-T△S<0,則該反應能自發進行,反應2Mg(s)+CO2(g)=C(s)+2MgO(s)能自發進行,且熵變小于0,則△H<0,故A正確;
B.Ag、Al和食鹽水構成原電池,正極上硫化銀得電子發生還原反應生成硫化氫和Ag,從而除去硫化銀,故B正確;
C.常溫下,將醋酸鈉稀釋后濃度降低,醋酸根離子水解程度增大,則溶液中c(OH-)減小,溫度不變,離子積常數不變,n(H+)•n(OH-)=c(H+)V×c(OH-)V=Kw×V2,溶液體積增大,所以n(H+)•n(OH-)增大,故C錯誤;
D.CaO和水反應生成氫氧化鈣且放出熱量,放出的熱量導致溶液溫度升高,降低氫氧化鈣溶解度,則Ca2+數目減小,pH降低,故D錯誤;
故選CD.
點評 本題考查較綜合,涉及難溶物溶解平衡、鹽類水解、原電池原理等知識點,側重考查學生分析判斷能力,明確難溶物溶解特點、鹽類水解特點是解本題關鍵,易錯選項是CD,注意D為“絕熱”條件會導致溶液溫度升高,氫氧化鈣溶解度隨著溫度升高而降低,為易錯點.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | Mg | B. | Mg | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | Mg |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 常溫下,向含有AgCl固體的飽和溶液,加少量水稀釋,c(Ag+)和Ksp(AgCl)均保持不變 | |
| B. | pH=5的CH3COOH與CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 將0.2mol/LCH3COOH溶液和0.1mol/LNaOH溶液等體積混合,則反應后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 將水加熱煮沸,能促進水的電離,Kw增大,pH增大,溶液呈堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
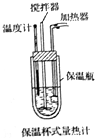 化學反應過程中總是伴隨著能量的變化,能量間可以相互轉化.
化學反應過程中總是伴隨著能量的變化,能量間可以相互轉化.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
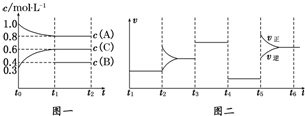
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ag C2H4和C3H6的混合物所含原子總數為$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-離子數為NA | |
| C. | 10 mL質量分數為98%的H2SO4,用水稀釋至100 mL,H2SO4的質量分數為9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子數大于0.6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
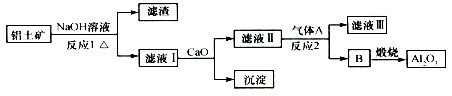
| A. | 氣體A一定為HCl | B. | 濾液Ⅰ中溶質可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸鈣 | D. | 反應1、反應2均是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該硫酸試劑的物質的量濃度為18.4 | |
| B. | 該硫酸與等體積的水混合所得溶液的質量分數小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取該硫酸12.5mL | |
| D. | 2.4gMg與足量的該硫酸反應得到H2 的體積為2.24L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com