
分析 根據有機物A的蒸氣與空氣的相對密度是1.6計算A的相對分子質量,根據質量守恒定律判斷3g有機物中是否含有O元素,并計算O原子的質量,進而計算C、H、O的物質的量比值,結合相對分子質量可得該有機物的化學式,此有機物可以與Na發生置換反應,說明含有羥基,以此解答.
解答 解:n(CO2)=0.1mol,則2.3g有機物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,則2.3g有機物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
因(1.2g+0.3g)<2.3g,所以有機物中還應還用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,
該化合物的蒸氣與空氣的相對密度是1.6,則有機物A的相對分子質量=29×1.6=46,有機物A中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,所以該有機物的最簡式為C2H6O,而C2H6O的相對分子質量為46,所以該有機物的分子式為C2H6O,
此有機物可以與Na發生置換反應,說明含有羥基,應為乙醇,有機物與乙酸發生酯化反應的方程式為2C2H5OH+2Na=2C2H5ONa+H2↑,
故答案為:2C2H5OH+2Na=2C2H5ONa+H2↑.
點評 本題考查了有機物分子式的計算,題目難度不大,注意掌握確定有機物分子式、結構簡式的方法,明確氣體的密度與氣體摩爾質量之間的關系是解答本題的關鍵.


 學而優銜接教材南京大學出版社系列答案
學而優銜接教材南京大學出版社系列答案 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:選擇題
| A. | 平衡常數的大小只與溫度有關,而與濃度、壓強、催化劑等無關 | |
| B. | 在任何條件下,化學平衡常數都是一個定值 | |
| C. | 在平衡常數表達式中,反應物濃度用起始濃度,生成物濃度用平衡濃度 | |
| D. | 從平衡常數大小可以推斷一個反應進行的快慢 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗 編號 | 實驗目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 為以下實驗作參考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究溫度對降解反應速率的影響 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH對降解反應速率的影響 | 298 | 10 | 6.0 | 0.30 |
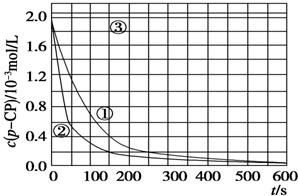 [數據處理]
[數據處理]查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
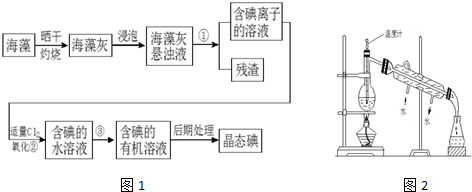
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
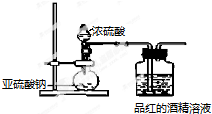
| 同濃度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 較上面少 | 較上面多 | 較上面多 | 慢 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com