
| 物質 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
分析 (1)加入的物質用于調節pH以除去雜質,主要將鐵離子轉化為氫氧化鐵沉淀,且不能引入新雜質,先根據溶液的pH計算氫離子濃度,再結合水的離子積常數計算氫氧根離子濃度,最后根據c(Fe3+)=$\frac{Kw[Fe(OH){\;}_{3}]}{C{\;}^{3}(OH{\;}^{-})}$計算c(Fe3+);
(2)加熱時促進氯化銅的水解且生成的氯化氫易揮發造成水解完全,要想得到較純的無水氯化銅應在氯化氫氣流中抑制其水解;
(3)依據碘化鉀和氯化銅發生氧化還原反應,生成碘化亞銅沉淀,和碘單質,碘單質遇淀粉變藍,依據碘單質被Na2S2O3標準溶液滴定到終點,發生反應離子方程式計算分析.
解答 解:(1)為得到純凈的CuCl2•2H2O晶體要除去氯化鐵,則溶液中的Fe3+轉化為Fe(OH)3沉淀,加入物質能與酸反應能轉化為氯化銅,所以應該加入含銅元素和氫氧根離子的物質,可以是氫氧化銅或堿式碳酸銅;溶液的pH=4,所以溶液中氫離子濃度為10-4 mol/L,則氫氧根離子濃度為10-10 mol/L,c(Fe3+)=$\frac{Kw[Fe(OH){\;}_{3}]}{C{\;}^{3}(OH{\;}^{-})}$=$\frac{2.6×10{\;}^{-39}}{(1×10{\;}^{-10}){\;}^{3}}$=2.6×10-9mol/L,
故答案為:Cu(OH)2或Cu2(OH)2CO3 ;2.6×10-9mol/L;
(2)由于CuCl2在加熱過程中水解被促進,且生成的HCl又易揮發而脫離體系,造成水解完全,堿式氯化銅或氫氧化銅,以至于得到CuO固體,而不是CuCl2,要想得到較純的無水氯化銅應在氯化氫氣流中抑制其水解,
故答案為:在干燥的HCl氣流中加熱脫水;
(3)測定含有CuCl2•2H2O晶體的試樣(不含能與I-發生反應的氧化性質雜質)的純度,過程如下:取0.36g試樣溶于水,加入過量KI固體,充分反應,生成白色沉淀.用0.1000mol/L Na2S2O3標準溶液滴定,到達滴定終點時,消耗Na2S2O3標準溶液20.00mL;反應的化學方程式為:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸鈉滴定碘單質,利用碘單質遇淀粉變藍選擇指示劑為淀粉;終點為藍色褪去,溶液中30s內不恢復原色,
故答案為:淀粉溶液;藍色褪去,溶液中30s內不恢復原色;
②CuCl2溶液與KI反應的離子方程式為為:2Cu2++4I-=2CuI↓+I2,
故答案為:2Cu2++4I-=2CuI↓+I2;
③依據2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0200L 0.002mol
則CuCl2•2H2O的物質的量為:0.002mol,
試樣中CuCl2•2H2O的質量百分數為:$\frac{0.002mol×171g/mol}{0.36g}$×100%=95%,
故答案為:95%.
點評 本題考查Ksp計算和物質制備,為高頻考點,側重于學生的分析能力、實驗能力和計算能力,題目涉及利用平衡移動原理、氧化還原滴定分析解答,明確滴定過程的反應原理和計算方法是解本題的關鍵,注意加熱灼燒CuCl2溶液和CuSO4溶液得到固體的區別,為易錯點,題目難度中等.


科目:高中化學 來源: 題型:實驗題
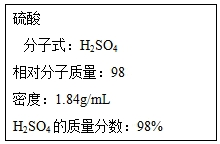 根據要求回答下列問題:
根據要求回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
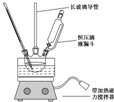 硝基苯是重要的精細化工原料,是醫藥和染料的中間體,還可做有機溶劑.制備硝基苯的過程如下:
硝基苯是重要的精細化工原料,是醫藥和染料的中間體,還可做有機溶劑.制備硝基苯的過程如下: +HNO3(濃)$\frac{50~60℃}{98%濃{H}_{2}S{O}_{4}}$+
+HNO3(濃)$\frac{50~60℃}{98%濃{H}_{2}S{O}_{4}}$+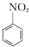 +H2O
+H2O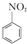 +HNO3(濃)$\frac{95%}{98%濃{H}_{2}S{O}_{4}}$
+HNO3(濃)$\frac{95%}{98%濃{H}_{2}S{O}_{4}}$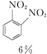 +
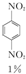
+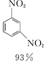 +
+
| 物質 | 熔點/℃ | 沸點/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 難溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 濃硝酸 | - | 83 | 1.4 | 易溶于水 |
| 濃硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 用1-丁醇、溴化鈉和較濃H2SO4混合物為原料,在實驗室制備1-溴丁烷,并檢驗反應的部分副產物.(已知:NaCl+H2SO4(濃)=NaHSO4+HCl↑)現設計如下裝置,其中夾持儀器、加熱儀器及冷卻水管沒有畫出.請回答下列問題:
用1-丁醇、溴化鈉和較濃H2SO4混合物為原料,在實驗室制備1-溴丁烷,并檢驗反應的部分副產物.(已知:NaCl+H2SO4(濃)=NaHSO4+HCl↑)現設計如下裝置,其中夾持儀器、加熱儀器及冷卻水管沒有畫出.請回答下列問題:| 物質 | 熔點/0C | 沸點/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
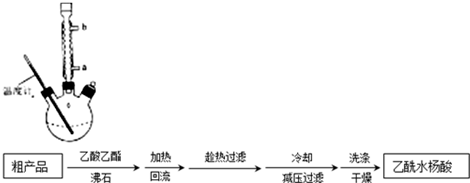
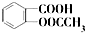 )是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.
)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.
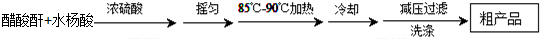
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸點) | 易水解 |
| 乙酰水楊酸 | 180 | 135(熔點) | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學式 | 電離常數 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

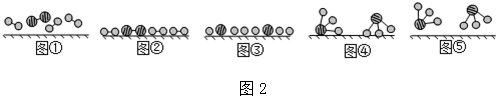
 分別表示N2、H2、NH3.圖⑤表示生成的NH3離開催化劑表面,圖②和③的含義分別是N2、H2被吸附在催化劑表面、在催化劑表面,N2、H2中化學鍵斷裂.
分別表示N2、H2、NH3.圖⑤表示生成的NH3離開催化劑表面,圖②和③的含義分別是N2、H2被吸附在催化劑表面、在催化劑表面,N2、H2中化學鍵斷裂.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com