
【題目】A、B、C、D四種元素,原子序數依次增大,A原子的最外層上有4個電子;B的陰離子和C的陽離子具有相同的電子層結構,兩元素的單質反應,生成一種淡黃色的固體E,D的L層電子數等于K、M兩個電子層上的電子數之和。
(1)A為______,B為______,C為______。
(2)E的電子式為 。
(3)寫出D的最高價氧化物的水化物和A單質反應的化學方程式:__ ___。
【答案】(1)C;O;Na;
(2)![]() ;
;
(3)C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
【解析】試題分析:A、B、C、D四種元素,原子序數依次增大,A原子的最外層上有4個電子,則A是C元素;B的陰離子和C的陽離子具有相同的電子層結構,兩元素的單質反應,生成一種淡黃色的固體E,則B是O元素,C是Na元素,E是Na2O2;D的L層電子數等于K、M兩個電子層上的電子數之和,則D是S元素。(1)A是C元素,B是O元素,C是Na元素;(2)E是Na2O2,其電子式為![]() ;(3)D的最高價氧化物的水化物是H2SO4,該物質具有強的氧化性,可以和C單質在加熱時發生反應,產生SO2、CO2和水,反應的化學方程式是C+2H2SO4(濃)
;(3)D的最高價氧化物的水化物是H2SO4,該物質具有強的氧化性,可以和C單質在加熱時發生反應,產生SO2、CO2和水,反應的化學方程式是C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】水中因含有機物而具有較高的化學耗氧量。常用酸性KMnO4氧化有機物測其含量。主要操作步驟如下:

(1)儀器A為________(填酸式或堿式)滴定管;要順利完成實驗,步驟Ⅲ中溶液顏色應為________;
(2)完善步驟Ⅳ涉及的離子方程式:______C2O42-+ MnO4-+ H+= Mn2++ CO2↑+ ;該步驟中滴入第一滴Na2C2O4時褪色較慢,以后的滴定中褪色較快,其原因是
(3)若步驟Ⅳ中所用Na2C2O4溶液為20.00mL,已知滴定后的液面如圖所示,請在圖2中標出滴定前的液面.
(4)若實驗測量結果比實際有機物含量偏高,分別從以下兩個方面猜想:
猜想1:水樣中Cl-影響
猜想2:配制Na2C2O4標液定容時________;
(5)若猜想1成立,請根據資料卡片補充完善上述實驗以消除Cl-影響.(限選試劑:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)________。
資料卡片:
①有機質可HNO3被氧化
②AgCl不與酸性KMnO4溶液反應
③Ag2C2O4可被酸性KMnO4溶液氧化。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮可以形成多種化合物,如NH3、N2H4、NH4NO3、NF3等。
(1)已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
則N2H4(l)+O2(g)═N2(g)+2H2O △H= _________kJmol-1;
(2)污水中的NH4+可以用氧化鎂處理,發生如下反應:
MgO+H2O![]() Mg(OH)2Mg(OH)2+2NH4+
Mg(OH)2Mg(OH)2+2NH4+![]() Mg2++2NH3H2O
Mg2++2NH3H2O

①溫度對氮處理率的影響如圖所示.在25℃前,升高溫度氮去除率增大的原因是________________;
②剩余的氧化鎂,不會對廢水形成二次污染,理由是________________;
(3)污水中的含氮化合物,通常先用生物膜脫氮工藝進行處理在硝化細菌的作用下將NH4+氧化為NO3-(2NH4++3O2═2HNO2+2H2O+2H+;2HNO2+O2=2HNO3).然后加入甲醇,甲醇和NO3-反應轉化為兩種無毒氣體.
①上述方法中,14g銨態氮元素轉化為硝態氮元素時需氧的質量為_______g。
②寫出加入甲醇后反應的離子方程式________________;
(4)使用NaBH4為誘導劑,可使Co2+與肼在堿性條件下發生反應,制得高純度納米鈷,該過程不產生有毒氣體。
①寫出該反應的離子方程式________________;
②在納米鈷的催化作用下,肼可分解生成兩種氣體,其中一種能使濕潤的紅色石蕊試紙變藍.若反應在不同溫度下達到平衡時,混合氣體中各組分的體積分數如下圖1所示,則N2H4發生分解反應的化學方程式為________________;

(5)在微電子工業中NF3常用作氮化硅的蝕刻劑,工業上通過電解含NH4F等的無水熔融物生產NF3,其電解原理如上圖2所示。寫出a電極的電極反應式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“關愛生命,注意安全”。慘痛的天津爆炸觸目驚心,火災之后依然火勢綿延不絕的原因之一是易燃物中含有電石。工業上常用電石(主要成分為CaC2,雜質為CaS等)與水反應生產乙炔氣。
(1)工業上合成CaC2主要采用氧熱法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考慮熱量耗散,物料轉化率均為100%,最終爐中出來的氣體只有CO,為維持熱平衡,每生產l molCaC2,轉移電子的物質的量為_______。
(2)已知2000℃時,合成碳化鈣的過程中還可能涉及到如下反應
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
則K1=_______ (用含K2、K3的代數式表示);c=_____(用含a、b的代數式表示)。
(3)利用電石產生乙炔氣的過程中產生的H2S氣體制取H2,既廉價又環保。

①利用硫化氫的熱不穩定性制取氫氣。在體積為2L的恒容密閉容器中,H2S起始物質的量為2mol,達到平衡后H2S的轉化率![]() 隨溫度和壓強變化如圖l所示。據圖計算T1℃時壓強P1時,硫為氣態,則平衡體系中H2的體積分數_____。由圖知壓強P1__P2(填“大于”“小于”或“等于”),理由是______。
隨溫度和壓強變化如圖l所示。據圖計算T1℃時壓強P1時,硫為氣態,則平衡體系中H2的體積分數_____。由圖知壓強P1__P2(填“大于”“小于”或“等于”),理由是______。
②電化學法制取氫氣的原理如圖2,請寫出反應池中發生反應的離子方程式_____,惰性電極a上發生的電極反應式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是由甲苯為起始原料的一系列變化,請填寫下列空白:
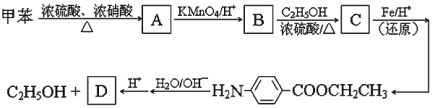
⑴ 寫出化合物 B 的結構簡式: 。
⑵ 由 B 到 C 的反應類型是 。
⑶ 任意寫出兩種同時符合下列要求的化合物 C 的同分異構體的結構簡式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯環上的一個取代基是硝基;
② 分子中含有 -COO- 結構的基團。
![]()
![]()
![]()
⑷ E、F、G 中有一種化合物經酸性水解,其中的一種產物能與FeCl3溶液發生顯色反應,這種化合物是 (在 E、F、G 中選擇,填字母)。
⑸ 一定條件下,化合物 D 發生聚合反應的化學方程式是: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4既是一種重要的能源,也是一種重要的化工原料。
(1)已知E(N-N)=a kJ/mol,E(N≡N)=b kJ/mol,E(N-H)=c kJ/mol,E(H-O)=d kJ/mol,E(O=O)=e kJ/mol,則:
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=____________________kJ·mol-1
(2)以CH4為燃料可設計成結構簡單、能量轉化率高、對環境無污染的燃料電池,其工作原理如圖1所示,則通入a氣體的電極名稱為 ,通入b氣體的電極反應式為 。(質子交換膜只允許H+通過)

(3)在一定溫度和催化劑作用下,CH4和CO2可直接生成乙酸,這是實現“減排”的一種研究方向。
①在不同溫度下,催化劑的催化效率與乙酸的生成速率如圖2所示,則該反應的最佳溫度控制在 左右。
②該反應催化劑的有效成分為偏鋁酸亞銅(CuAlO2,難容物),將CuAlO2溶解在稀硝酸中生成兩種鹽并放出NO氣體,其離子方程式為 。
(4)CH4還原法是處理NOX氣體的一種方法。已知一定條件下CH4與NOX反應轉化為N2和CO2,若標準狀況下8.96L CH4可處理22.4L NOX,則X值為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置主要部分見下圖,相關物質的沸點見附表)。

附表相關物質的沸點(101kPa)

步驟1:將三頸瓶中的一定配比的無水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升溫至60℃,緩慢滴加經H2SO4干燥過的液溴,保溫反應一段時間,冷卻.
步驟2:將反應混合物緩慢加入一定量的稀鹽酸中,_________________。
步驟3:有機相用10%NaHCO3溶液洗滌,再加入適量無水MgSO4固體,放置一段時間后過濾;
步驟4:減壓蒸餾有機相,收集相應餾分。
(1)實驗裝置中可能的錯誤有______________,冷凝管進水口是______________;
(2)有同學建議將裝置中溫度計換成攪拌棒,那么溫度計應移到什么地方使用______________;
(3)步驟2后續操作是_____________;
(4)步驟3中用10%NaHCO3溶液洗滌的具體操作是____________________,加入無水MgSO4固體的作用是______________。
(5)步驟4中采用蒸餾分離,請你預測蒸餾溫度應先選擇約_______℃,再選擇約_______℃。
A.50 B.100 C.150 D.200 E.250 F.300
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴化鈣可用于石油鉆井,也可用于制造溴化銨及光敏紙、滅火劑、制冷劑等。制備CaBr22H2O的主要流程如下:

工業提取液溴主要采用空氣吹出法,其主要流程如下:

請回答:
(1)Fe與液溴的反應溫度不能超過40℃的原因是_________。
(2)試劑B最好選用_________。
(3)操作Ⅰ的步驟為蒸發濃縮、、________、洗滌、干燥。
(4)下列說法中錯誤的是_________。
a.濾渣A的成分可能是Fe、Fe(OH)2 、Fe(OH)3;
b.操作Ⅱ的名稱是萃取
c.流程圖中虛線框部分步驟的主要目的是除去雜質、富集Br2
d.成品溴中含有的少量Cl2,可加入Na2SO3溶液,然后分液除去
(5)制得的CaBr22H2O可以通過以下方法測定純度:稱取5.00 g樣品溶于水,滴入足量Na2CO3溶液,充分反應后抽濾,將沉淀洗滌、烘干、冷卻、稱量,得到2.00 g固體。
①抽濾時用到的儀器除了安全瓶、抽氣泵外,還需要_____________________________。
②抽濾中洗滌沉淀的操作方法是_________。
③以下關于抽濾的操作不正確的是________________
A.放在布氏漏斗內的濾紙大小應略小于漏斗內徑,但又能將全部小孔蓋住
B.過濾時,溶液量不應超過漏斗容量的2/3
C.吸濾瓶內液面將達到支管口時,應拔掉抽濾瓶上的橡皮管,從支管口處倒出溶液
D.停止吸濾時,應先拆下連接抽氣泵和抽濾瓶的橡皮管,然后關閉水龍頭
④測得CaBr22H2O的質量分數為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4molA氣體和2molB氣體在2L的密閉容器中混合,在一定條件下發生如下反應:2A(g)+B(g)![]() 2C(g)若經過2秒后測得C的濃度為0.6mol/L。
2C(g)若經過2秒后測得C的濃度為0.6mol/L。
則:(1)2s內用B表示的反應速率 。
(2)2s時A的物質的量濃度為 。
(3)2s時B的物質的量為 。
(4)最終C的濃度 (填“能”或“不能”)達到2mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com