
【題目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同學設計如下實驗,通過測量反應前后C、D裝置質量的變化,測定該混合物中各組分的質量分數。
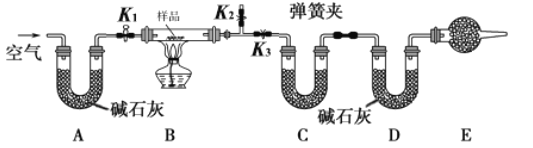
(1)請將實驗步驟補充完整
①按圖(夾持儀器未畫出)組裝好實驗裝置后,首先進行的操作是 _____________________。
②稱取樣品,并將其放入硬質玻璃管中;并稱量C、D裝置的質量。
③打開活塞K1和K2,關閉K3,緩慢鼓入空氣數分鐘,其目的是____________________。
④關閉活塞K1和K2,打開K3,點燃酒精燈加熱至不再產生氣體。
⑤打開活塞K1,緩緩鼓入空氣數分鐘,然后卸下裝置,再次稱量C、D裝置的質量。
(2)關于該實驗方案,請回答下列問題:
①若加熱反應后不鼓入空氣,對NaCl測定結果的影響是___________(“偏高”、“偏低”或“無影響”)
②E處干燥管中盛放的藥品是_______________,其作用是_____________________________,如果實驗中沒有該裝置,則會導致測量結果NaHCO3的質量分數______________(“偏高”、“偏低”或“無影響”)
③若樣品質量為wg,反應后C、D裝置增加的質量分別為m1g和m2g,由此可知混合物中Na2CO3·10H2O的質量分數為______(用含w、m1、m2的代數式表示)。
【答案】檢查裝置氣密性 趕走裝置中含有的水蒸氣和二氧化碳,減少誤差 偏高 堿石灰 吸收外界空氣中的二氧化碳和水蒸氣 偏高 ![]() ×(m1-
×(m1-![]() m2)×100%
m2)×100%
【解析】
含NaCl、Na2CO310H2O和NaHCO3的混合物加熱時,碳酸氫鈉分解生成碳酸鈉、二氧化碳和水,碳酸鈉晶體失去結晶水生成碳酸鈉,反應的化學方程式為:2NaHCO3![]() Na2CO3+H2O↑+CO2↑;Na2CO310H2O
Na2CO3+H2O↑+CO2↑;Na2CO310H2O![]() Na2CO3+10H2O↑。產生的H2O(g)、CO2,應在C、D中分別吸收,由干燥劑的性質知應先吸收水,再吸收二氧化碳,即C中的干燥劑吸水但不能吸收CO2;由D的增重(NaHCO3分解產生的CO2的質量)可求出NaHCO3質量。由C的增重(Na2CO310H2O分解產生的H2O及已經知道的NaHCO3分解產生的H2O的質量)可求出Na2CO310H2O的質量,從而求出NaCl的質量,據此分析解答。
Na2CO3+10H2O↑。產生的H2O(g)、CO2,應在C、D中分別吸收,由干燥劑的性質知應先吸收水,再吸收二氧化碳,即C中的干燥劑吸水但不能吸收CO2;由D的增重(NaHCO3分解產生的CO2的質量)可求出NaHCO3質量。由C的增重(Na2CO310H2O分解產生的H2O及已經知道的NaHCO3分解產生的H2O的質量)可求出Na2CO310H2O的質量,從而求出NaCl的質量,據此分析解答。
(1)①由實驗原理可知,實驗需要通過測量D裝置內堿石灰的增重,計算生成的二氧化碳的質量,通過測量C裝置內的增重,計算生成的水的質量,故應首先檢驗裝置的氣密性,故答案為:檢查裝置氣密性;
③裝置內有空氣,空氣中含有水蒸氣和二氧化碳,影響水蒸氣和二氧化碳質量的測定,打開活塞K1、K2,關閉活塞K3,實驗前要通入空氣,趕走裝置中含有水蒸氣和二氧化碳,減少誤差,故答案為:除去裝置中的水蒸氣和二氧化碳;
(2)①若加熱反應后不鼓入空氣,使得水蒸氣和二氧化碳的質量測定結果會減小,碳酸氫鈉依據二氧化碳計算,而Na2CO310H2O的測定是根據生成水的總質量計算的,測得的NaHCO3和Na2CO310H2O的含量將偏小,則NaCl的測定結果將偏高,故答案為:偏高;
②E處干燥管是防止外界空氣中的水蒸氣和二氧化碳影響實驗結果,因此干燥管中盛放堿石灰,因為堿石灰能吸收空氣中的水蒸氣和二氧化碳,若沒有E裝置,則測定的碳酸氫鈉的質量偏高,故答案為:堿石灰;吸收外界空氣中的二氧化碳和水蒸氣;偏高;
③含NaCl、Na2CO310H2O和NaHCO3的混合物加熱時,碳酸氫鈉分解生成碳酸鈉、二氧化碳和水,碳酸鈉晶體失去結晶水生成碳酸鈉,反應的化學方程式為:2NaHCO3![]() Na2CO3+H2O↑+CO2↑;Na2CO310H2O
Na2CO3+H2O↑+CO2↑;Na2CO310H2O![]() Na2CO3+10H2O↑。D裝置中增加的質量為二氧化碳的質量,設碳酸氫鈉分解生成的水蒸氣的質量為x,
Na2CO3+10H2O↑。D裝置中增加的質量為二氧化碳的質量,設碳酸氫鈉分解生成的水蒸氣的質量為x,
2NaHCO3![]() Na2CO3+H2O + CO2↑
Na2CO3+H2O + CO2↑
18g 44g
x m2g
![]() =
=![]() ,解得x=
,解得x=![]() m2g
m2g
裝置C吸收的是水蒸氣,包括碳酸氫鈉分解生成的和Na2CO310H2O分解生成的水,則Na2CO310H2O分解生成的水蒸氣的質量=m1g -![]() m2g =(m1-
m2g =(m1-![]() m2)g,設Na2CO310H2O的質量為y,
m2)g,設Na2CO310H2O的質量為y,
Na![]() Na2CO3+10H2O
Na2CO3+10H2O
286g 180g
y (m1-![]() m2)g
m2)g
![]() =
=![]() ,解得:y=
,解得:y=![]() ×(m1-
×(m1-![]() m2)g,所以Na2CO3·10H2O的質量分數=
m2)g,所以Na2CO3·10H2O的質量分數=![]() ×100%=
×100%=![]() ×(m1-
×(m1-![]() m2)×100%,故答案為:
m2)×100%,故答案為:![]() ×(m1-
×(m1-![]() m2)×100%。
m2)×100%。


科目:高中化學 來源: 題型:
【題目】一種磁性材料的磨削廢料(含鎳質量分數約21%)主要成分是鐵鎳合金,還含有銅、鈣、鎂、硅的氧化物。由該廢料制備純度較高的氫氧化鎳,工藝流程如下

回答下列問題:
(1)“酸溶”時,溶液中有Fe3+、Fe2+、Ni2+等生成,廢渣的主要成分是__________;金屬鎳溶解的離子方程式為__________________________________________。
(2)“除鐵”時H2O2的作用是___________________,加入碳酸鈉的目的是__________________________________________。
(3)“除銅”時,反應的離子方程式為_____________________________________,若用Na2S代替H2S除銅,優點是__________。
(4)已知除鈣鎂過程在陶瓷容器中進行,NaF的實際用量不能過多的理由為_____________________。
(5)已知常溫下Ksp[Ni(OH)2]=2.0×10-15,該流程在“沉鎳”過程中需調節溶液pH約為_______,Ni2+才剛好沉淀完全(離子沉淀完全的濃度≤10-5 mol/L;lg2=0.30)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,分別將0.1molNa、Na2O、Na2O2、NaOH加入盛有100mL水(設水的密度為1g/cm3)的甲、乙、丙、丁四個燒杯中并恢復至原溫度,則甲、乙、丙、丁四燒杯中溶液的質量分數大小關系為
A. 丙>乙>丁>甲 B. 丁>甲>乙>丙 C. 乙=丙>甲>丁 D. 丁>丙=乙>甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據烯烴、炔烴的命名原則,回答下列問題:
(1)有機物![]() 的系統名稱為______________,使其在催化劑存在條件下完全氫化,所得烷烴的系統名稱為______________。
的系統名稱為______________,使其在催化劑存在條件下完全氫化,所得烷烴的系統名稱為______________。
(2)有機物![]() 的系統名稱為_____________,使其在催化劑存在條件下完全氫化,所得烷烴的系統名稱為_____________。
的系統名稱為_____________,使其在催化劑存在條件下完全氫化,所得烷烴的系統名稱為_____________。
(3)有機物2-甲基-2-戊烯的結構簡式為_________。
(4)某烯烴的錯誤命名是2-甲基-4-乙基-2-戊烯,則它的正確命名是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏加德羅常數的值為NA,下列說法正確的是
A. 標準狀況下,2.24LCH3OH分子中共價鍵的數目為0.5NA
B. 1molNa2O2與足量CO2充分反應,轉移的電子數為2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水電離出H+的數目為0.01NA
D. 0.1molH2和0.1molI2于密閉容器中充分反應后,HI分子總數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列物質中,其核磁共振氫譜中只有一個吸收峰的是____(填字母,雙選)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氫譜圖如圖所示,則A的結構簡式為____,請預測B的核磁共振氫譜上應該有____個吸收峰。

(3)化合物C中各原子數目比為N(C)∶N(H)∶N(O)=1∶2∶1,對化合物C進行質譜分析可得到圖示的質譜圖,則其分子式為____。若對其進行紅外光譜分析,可得出其官能團為____(填名稱)。確定化合物C的官能團時,你認為____(填“有”或“沒有”)必要進行紅外光譜分析。寫出化合物C與足量新制氫氧化銅懸濁液反應的化學方程式____________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物的表示方法多種多樣,下面是常用的有機物的表示方法:
①![]() ②
② ③CH4 ④
③CH4 ④  ⑤
⑤![]()
⑥

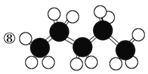

⑩
(1)上述表示方法中屬于結構簡式的為__________;
屬于結構式的為________;
屬于鍵線式的為________;
屬于比例模型的為________;
屬于球棍模型的為________。
(2)寫出⑨的分子式:________。
(3)寫出⑩中官能團的電子式:________、________。
(4)②的分子式為________,最簡式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X是一種具有果香味的合成香料,下圖為合成X的某種流程:

提示:①![]() 不能最終被氧化為—COOH;
不能最終被氧化為—COOH;
②D的產量可以用來衡量一個國家的石油化工水平。
請根據以上信息,回答下列問題:
(1)C分子中官能團的名稱是__________,E的結構簡式是________。
(2)D+E→X的化學反應類型為________反應。
(3)上述A、B、C、D、E、X六種物質中,互為同系物的是____________________。
(4)C的一種同分異構體F可以發生水解反應,則F的結構簡式為________、 ________。
(5)反應C+E→X的化學方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)實驗室制取氯氣時,下列操作不正確的是________(填字母)。


A.裝置Ⅰ可用于制取少量氯氣
B.用裝置Ⅱ除去氯氣中的少量氯化氫
C.用裝置Ⅲ制取氯氣
D.用裝置Ⅳ干燥氯氣
(2)實驗室制取干燥、純凈的氯氣,除了二氧化錳、濃鹽酸外還需要的試劑____、_____、______。
(3)已知高錳酸鉀與濃鹽酸在常溫下反應能產生氯氣。若用如下圖所示的實驗裝置來制備純凈、干燥的氯氣及驗證它與金屬的反應。每個虛線框表示一個單元裝置,其中有錯誤的是________(填字母)。

(4)氯氣是有毒氣體,必須進行尾氣處理,寫出實驗室氯氣尾氣處理的離子方程式___________。
(5)漂白液(次氯酸鈉)和潔廁靈(鹽酸)不能混合使用會產生氯氣有毒氣體的離子方程式:____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com