
| A. | 鐵和氯化鐵溶液反應:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氫氧化鈉溶液反應:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 實驗室用MnO2和濃鹽酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氫氧化鐵和鹽酸反應:H++OH-═H2O |
分析 A.電子、電荷不守恒;
B.反應生成醋酸鈉和水;
C.電荷、原子不守恒;
D.氫氧化鐵在離子反應中保留化學式.
解答 解:A.鐵和氯化鐵溶液反應的離子反應為2Fe3++Fe═3Fe2+,故A錯誤;
B.醋酸和氫氧化鈉溶液反應的離子反應為CH3COOH+OH-═CH3COO-+H2O,故B正確;
C.實驗室用MnO2和濃鹽酸制取Cl2的離子反應為MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故C錯誤;
D.氫氧化鐵和鹽酸反應的離子反應為3H++Fe(OH)3═Fe3++3H2O,故D錯誤;
故選B.
點評 本題考查離子反應方程式書寫的正誤判斷,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重復分解反應、氧化還原反應的離子反應考查,注意離子反應中保留化學式的物質及電子、電荷守恒,題目難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
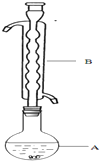 Na2S2O3俗稱大蘇打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加熱反應,可以制得Na2S2O3.已知10℃和70℃時,Na2S2O3在100g水中的溶解度分別為60.0g和212g.常溫下,從溶液中析出的晶體是Na2S2O3•5H2O.
Na2S2O3俗稱大蘇打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加熱反應,可以制得Na2S2O3.已知10℃和70℃時,Na2S2O3在100g水中的溶解度分別為60.0g和212g.常溫下,從溶液中析出的晶體是Na2S2O3•5H2O.| 滴定次數 | 滴定前讀數(mL) | 滴定滴定后讀數(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
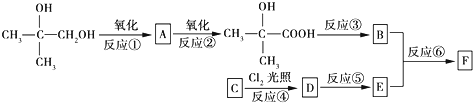
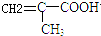 $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$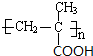 .
.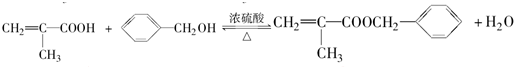 .
.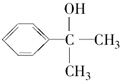 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的離子方程式為CO32-+2H+═CO2↑+H2O | |
| B. | 與同濃度的鹽酸反應,塊狀大理石的反應速率比粉末狀的大 | |
| C. | CaCO3溶于鹽酸是因為H+破壞了CaCO3的沉淀溶解平衡,使其ksp增大 | |
| D. | CaCO3與適量的鹽酸恰好完全反應所得溶液中c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com