
| A. | 1.7克氨氣中含有0.1NA個NH3分子 | |
| B. | 標準狀況下,2.24 L Cl2溶于水所得溶液中含有Cl_0.1NA | |
| C. | 標準狀況下,2.24 L H2O中含有0.1 NA個氧原子 | |
| D. | 0.1mol鐵在足量氯氣中燃燒,電子轉移0.2NA個 |
分析 A、求出氨氣的物質的量,然后根據分子個數N=nNA來計算;
B、氯氣和水的反應為可逆反應;
C、標況下水為液體;
D、鐵在氯氣中反應后變為+3價.
解答 解:A、1.7g氨氣的物質的量為0.1mol,故分子個數N=nNA=0.1NA個,故A正確;
B、氯氣和水的反應為可逆反應,故不能進行徹底,故水中的氯離子的個數小于0.1NA個,故B錯誤;
C、標況下水為液體,故不能根據氣體摩爾體積來計算其物質的量和含有的氧原子個數,故C錯誤;
D、鐵在氯氣中反應后變為+3價,故0.1mol鐵反應后轉移0.3NA個電子,故D錯誤.
故選A.
點評 本題考查了阿伏伽德羅常數的有關計算,難度不大,應注意公式的運用和物質的結構特點.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1(燃燒熱) | |
| B. | OH-(aq)+H+(aq)=H2O(l)△H=+57.3 kJ•mol-1(中和熱) | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1(反應熱) | |
| D. | 2NO2=O2+2NO△H=+116.2 kJ•mol-1(反應熱) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 電離能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
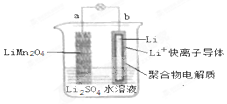 2013年3月我國科學家報道了如圖所示的水溶液鋰離子電池體系,放電時,該電池的反應為 Li1-xMn2O4+xLi=LiMn2O4.則下列敘述錯誤的是( )
2013年3月我國科學家報道了如圖所示的水溶液鋰離子電池體系,放電時,該電池的反應為 Li1-xMn2O4+xLi=LiMn2O4.則下列敘述錯誤的是( )| A. | a 為電池的正極 | |
| B. | 電池充電反應為 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放電時,a 極鋰的化合價發生變化 | |
| D. | 放電時,溶液中 Li+從 b 向 a 遷移 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗目的 | 操作 |
| A | 比較水和乙醇中羥基氫的活潑性強弱 | 用金屬鈉分別與水和乙醇反應 |
| B | 驗證淀粉已水解 | 向淀粉溶液中加入稀硫酸,水浴加熱,一段時間后,再加入新制的氫氧化銅懸濁液并加熱 |
| C | 比較Mg和Al的金屬活動性強弱 | 分別用鎂、鋁為電極,氫氧化鈉為電解質的原電池裝置中反應現象 |
| D | 除去苯中混有的苯酚 | 向混合液中加入過量濃溴水,充分反應后,過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
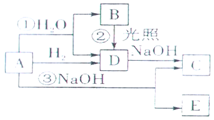 A是黃綠色氣體單質,如圖所示,
A是黃綠色氣體單質,如圖所示,查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 操作 | 現象 |
| 向反應瓶中加入6.5g鋅粉,然后加入50mL 1.0mol•L-1的FeCl3溶液,攪拌 | 溶液溫度迅速上升,稍后出現紅褐色沉淀,同時出現少量氣泡;反應一段時間后靜置,上層溶液為淺綠色,反應瓶底部有黑色固體 |
| 收集檢驗反應過程中產生的氣體 | 集氣管口靠近火焰,有爆鳴聲 |
| 操作 | 現象 |
| 將5mL 1.0mol•L-1的FeCl3溶液與0.65g鋅粉混合 | 溶液溫度迅速上升,開始時幾乎沒有氣泡 |
| 將5 mL 0.2 mol•L-1(或pH=0.7)的鹽酸與0.65g鋅粉混合 | 溶液中立即產生大量氣泡 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 沉淀X的成分是SiO2 | |
| B. | 將蛇紋石試樣直接溶于過量的NaOH溶液后過濾,可得到紅色顏料Fe2O3 | |
| C. | 在溶液Y中加入過量的NaOH溶液,過濾得到沉淀是Fe(OH)3 | |
| D. | 溶液Y中的陽離子主要是Mg2+、Al3+、Fe3+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com