
【題目】碳和氮的化合物在生產生活中廣泛存在。回答下列問題:
(1)催化轉化器可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
則尾氣轉化反應2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一種重要的化工原料,在工農業生產中有廣泛的應用。在773 K時,分別將2.00 mol N2和6.00 mol H2充入一個固定容積為1 L的密閉容器中,隨著反應的進行,氣體混合物中n(H2)、n(NH3)與反應時間(t)的關系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①該溫度下,若向同容積的另一容器中投入N2、H2、NH3,其濃度均為3 mol/L,則此時v正____v逆(填“大于”“小于”或“等于”)。
②由表中的實驗數據可得到“c—t”的關系,如圖所示,表示c(N2)—t的曲線是______。在此溫度下,若起始充入4 mol N2和12 mol H2,則反應剛達到平衡時,表示c(H2)—t的曲線上相應的點為________。

(3)NOx的排放主要來自于汽車尾氣,有人利用反應C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭對NO進行吸附。已知在密閉容器中加入足量的C和一定量的NO氣體,保持恒壓測得NO的轉化率隨溫度的變化如圖所示:
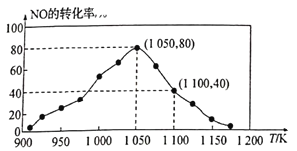
①由圖可知,在1100K時,CO2的體積分數為__________。
②用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(記作Kp)。在1050K、1.1×106Pa時,該反應的化學平衡常數Kp=______[已知:氣體分壓(P分)=氣體總壓(Pa)×體積分數]。
(4)在酸性電解質溶液中,以惰性材料作電極,將CO2轉化為丙烯![]() 原理如圖所示
原理如圖所示
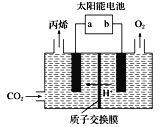
①太陽能電池的負極是_______(填“a”或“b”)
②生成丙烯的電極反應式是___________。
【答案】-746.5 kJ /mol 大于 乙 B 20% 4 a 3CO2+18H++18e-=C3H6+6H2O
【解析】
(1)根據蓋斯定律將已知的熱化學方程式,根據③×2-②-①疊加可得相應熱化學方程式;
(2)①由表中數據可知,25min達到平衡,根據物質反應轉化關系,計算出各種物質的瓶內濃度,得到該溫度下的化學平衡常數,將物質的此時濃度帶入濃度商計算并與K比較判斷;
②c(N2)從2mol/L減小為1mol/L,在此溫度下,若起始充入4 mol N2和12 molH2,壓強為原來的2倍,增大壓強平衡正向移動,則3mol/L<c(H2)<6mol/L;
(3)①由圖可知,1050K前反應中NO的轉化率隨溫度升高而增大,反應速率加快;圖中1100K時,NO的轉化率為40%,假設反應開始時NO的物質的量為a,根據NO的轉化率及物質反應轉化關系,計算出平衡時各種氣體的物質的量,利用阿伏加德羅定律及其推論計算體積分數;
②根據1050K、1.1×106Pa時,NO的轉化率為80%,計算出平衡時各種氣體的物質的量,結合氣體分壓(P分)=氣體總壓(Pa)×體積分數,以此計算Kp;
(4)由圖可知,陰極上CO2得到電子生成丙烯,則a為負極,以此來解答。
(1)由于反應熱與反應途徑無關,只與物質的始態和終態有關,所以根據蓋斯定律③×2-②-①進行疊加,可得相應熱化學方程式:NO(g) +2CO(g)=N2(g)+2CO2(g) △H=-746.5 kJ /mol;
(2)由表中數據可知,25min達到平衡,平衡時各種物質的濃度c(NH3)=2.0mol/L,c(H2)=3.0mol/L,c(N2)=1.0mol/L,則該溫度下的化學平衡常數K=![]() =
=![]() 。
。
①該溫度下,若向同容積的另一容器中投入N2、H2、NH3,其濃度均為3.0 mol/L,則Qc=![]() =
=![]() <K,說明反應正向進行,v正>v逆;
<K,說明反應正向進行,v正>v逆;
②c(N2)從2mol/L減小為1mol/L,則表示c(N2)-t的曲線是乙,在此溫度下,若起始充入4 mol N2和12 mol H2,壓強為原來的2倍,增大壓強,化學平衡向氣體體積減小的正反應方向移動,則3mol/L<c(H2)<6mol/L,且濃度增大,反應速率加快,則達到平衡時,表示c(H2)-t的曲線上相應的點為B;
(3)①由圖可知,1050K前反應中NO的轉化率隨溫度升髙而增大,其原因為1050K前反應未達到平衡狀態,隨著溫度升高,反應速率加快,NO轉化率增大;圖中1100K時,NO的轉化率為40%,則根據反應方程式C(s)+2NO(g)![]() N2(g)+CO2(g),假設反應開始時NO的物質的量為a,平衡時NO為0.6a,N2為0.2a,CO2為0.2a,由于在同溫同壓下,氣體的體積比等于氣體的物質的量的比,則CO2占的體積分數=
N2(g)+CO2(g),假設反應開始時NO的物質的量為a,平衡時NO為0.6a,N2為0.2a,CO2為0.2a,由于在同溫同壓下,氣體的體積比等于氣體的物質的量的比,則CO2占的體積分數=![]() ×100%=20%;
×100%=20%;
②1050K、1.1×106Pa時,NO的轉化率為80%,則根據反應方程式C(s)+2NO(g)![]() N2(g)+CO2(g),假設反應開始時NO的物質的量為a,平衡時NO為0.2a,N2為0.4a,CO2為0.4a,氣體的總物質的量為0.2a+0.4a+0.4a=a。氣體分壓=氣體總壓×氣體的體積分數,則化學平衡常數Kp=
N2(g)+CO2(g),假設反應開始時NO的物質的量為a,平衡時NO為0.2a,N2為0.4a,CO2為0.4a,氣體的總物質的量為0.2a+0.4a+0.4a=a。氣體分壓=氣體總壓×氣體的體積分數,則化學平衡常數Kp=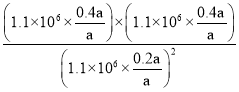 =4;
=4;
(4)①由圖可知,陰極上CO2中的C得到電子,發生還原反應,所以太陽能電池的負極是a;
②在a電極上生成丙烯的電極反應式是3CO2+18H++18e-=C3H6+6H2O。


科目:高中化學 來源: 題型:
【題目】在一定條件下,在容積為2L的密閉容器中,將2 mol 氣體M和3 mol N氣體混合,發生如下反應:2M(g) + 3N(g) ![]() x Q(g) +3R(g),該反應達平衡時,生成2.4mol R,并測得Q的濃度為0.4 mol/L,下列有關敘述正確的是
x Q(g) +3R(g),該反應達平衡時,生成2.4mol R,并測得Q的濃度為0.4 mol/L,下列有關敘述正確的是
A. x值為2 B. 混合氣體的密度增大
C. N的轉化率為20% D. 平衡時N的濃度為0.3 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下發生下列反應,其中屬于鹽類水解反應的是( )
A.CH3COO—+H2O![]() CH3COOH+OH—
CH3COOH+OH—
B.Cl2+H2O ![]() H++Cl-+HClO
H++Cl-+HClO
C.CH3COOH+NaOH![]() CH3COONa+H2O
CH3COONa+H2O
D.HCO3—+H2O![]() H3O++CO32-
H3O++CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T ℃時,在容積為2 L的3個恒容密閉容器中發生反應:3A(g)+B(g)![]() nC(g),按不同方式投入反應物,測得反應達到平衡時的有關數據如下:
nC(g),按不同方式投入反應物,測得反應達到平衡時的有關數據如下:
容器 | 甲 | 乙 | 丙 |
反應物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
達到平衡的時間/min | 5 | 8 | |
A的濃度/mol·L-1 | c1 | c2 | |
C的體積分數% | w1 | w3 | |
混合氣體的密度/g·L-1 | ρ1 | ρ2 |
下列說法正確的是( )
A. 若n<4,則2c1<c2
B. 若n=4,則w3=w1
C. 無論n的值是多少均有2ρ1=ρ2
D. 容器甲達到平衡所需的時間比容器乙達到平衡所需的時間短
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列圖示所得出的結論正確的是

A.圖甲表示壓強對可逆反應2A(g)+2B(g)![]() 3C(g)+D(s)的影響,乙的壓強比甲的壓強大
3C(g)+D(s)的影響,乙的壓強比甲的壓強大
B.圖乙是金剛石與石墨分別氧化生成CO2的能量關系曲線,說明石墨轉化為金剛石的反應的ΔH>0
C.圖丙表示一定條件下的合成氨反應中,NH3的平衡體積分數隨H2起始體積分數(N2的起始量恒定)的變化,圖中a點N2的轉化率大于b點
D.圖丁表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則相同條件下NaA溶液的pH大于同濃度的NaB溶液的pH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種化學名為 2,4,4—三氯—2— 羥基—二苯醚的物質(如下圖),被廣泛應用于肥皂、牙膏等日用化學品之中,有殺菌消毒等作用。則下列有關說法中正確的是 ( )

A. 該物質與 FeCl3溶液混合后不顯色
B. 該物質中所有原子一定處于同一平面
C. 該物質苯環上的一溴取代物有 6 種
D. 物質的分子式為 C12H6Cl3O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予美國固體物理學家約翰·巴尼斯特·古迪納(JohnB.Goodenough)、英國化學家斯坦利·威廷漢(StanleyWhittingham)和日本化學家吉野彰(AkiraYoshino),以表彰他們發明鋰離子電池方面做出的貢獻。全固態鋰硫電池能量密度高、成本低,其工作原理如圖所示,其中電極a常用摻有石墨烯的S8材料,電池反應為:16Li+xS8=8Li2Sx(2≤x≤8)。下列說法錯誤的是( )
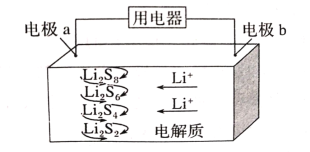
A.電池工作時,正極可發生反應:2Li2S6+2Li++2e-=3Li2S4
B.電池工作時,外電路中流過0.02mol電子,負極材料減重0.14g
C.石墨烯的作用主要是提高電極a的導電性
D.電池充電時間越長,電池中Li2S2的量越多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅是一種重要的化工原料,一種利用低品位銅礦![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 為原料制取CuCl的工藝流程如下:
為原料制取CuCl的工藝流程如下:
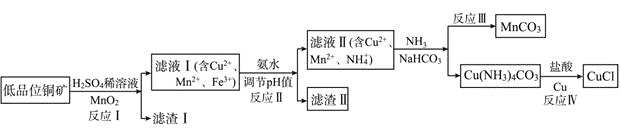
(1)反應Ⅰ“浸取”前需將銅礦粉碎的目的是___________________________;
(2)濾渣Ⅰ的成分除S和![]() 外還含有___________,反應 Ⅰ中
外還含有___________,反應 Ⅰ中![]() 的作用為_______________
的作用為_______________
(3)已知生成氫氧化物的pH如下表,則反應Ⅱ“中和”時,用氨水調pH的范圍是______________。
物質 |
|
|
|
開始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)檢驗濾液Ⅱ中是否含有![]() 所需要的試劑是:______________
所需要的試劑是:______________
(5)①反應Ⅲ中生成難溶![]() 的離子方程式:______________
的離子方程式:______________
②反應Ⅳ所對應的化學方程式:______________________________
(6) CuCl的定量分析
步驟1.取樣品0.7500g和30.0mL 1.0mol·L-1過量的FeCl3溶液置于250mL的錐形瓶中,不斷搖動。
步驟2.待樣品溶解后,平均分為3份,用0.1000mol·L-1 Ce(SO4)2標準溶液進行滴定。
三次實驗測得數據如下表
序號 | 1 | 2 | 3 |
起始讀數 |
|
|
|
終點讀數 |
|
|
|
已知:![]() ;
;![]() 。
。
①數據處理:計算得CuCl的純度為_________![]()
②誤差下列操作會使測定結果偏高的是______________
A.錐形瓶中有少量蒸餾水
B.滴定終點讀數時仰視滴定管刻度線
C.0.1000mol·L-1硫酸鈰溶液久置后濃度變小
D.滴定前滴定管尖嘴無氣泡,滴定后產生氣泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液時仰視刻度線
溶液時仰視刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于各實驗裝置圖的敘述中,正確的是( )
A.裝置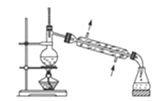 常用于分離互不相溶的液體混合物
常用于分離互不相溶的液體混合物
B.裝置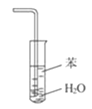 可用于吸收NH3,并防止倒吸
可用于吸收NH3,并防止倒吸
C.圖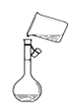 是將溶解好的溶液轉移到容量瓶中
是將溶解好的溶液轉移到容量瓶中
D.圖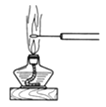 可觀察NaCl的焰色反應
可觀察NaCl的焰色反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com