
鐵及其化合物在生產、生活中有廣泛應用。請回答下列問題:
(1)水熱法制備Fe3O4納米顆粒的反應是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述離子方程式中x=________;
②每生成1 mol Fe3O4,反應轉移的電子為________mol;
(2)某高效凈水劑可由Fe(OH)SO4聚合得到。工業上以FeSO4、NaNO2和稀硫酸為原料來制備Fe(OH)SO4,反應中有NO生成,化學方程式為 。
高爐煉鐵過程中發生的主要反應為: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)

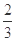 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知該反應在不同溫度下的平衡常數如下:
|
溫度/℃ |
1000 |
1115 |
1300 |
|
平衡常數 |
4.0 |
3.7 |
3.5 |
(3)該反應的平衡常數表達式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反應中CO的平衡轉化率,可采取的措施是 ;
A.提高反應溫度 B.移出部分CO2
C.加入合適的催化劑 D.減小容器的容積
(5)在一個容積為10L的密閉容器中,1000℃時加入Fe、Fe2O3、CO、CO2各1.0 mol,此時v正 v逆(填“等于”、“大于”或“小于”)。經過l0 min,在1000℃達到平衡,則該時間范圍內反應的平均反應速率v (CO2)= 。
(1)4、4
(2)2FeSO4 + 2NaNO2 + H2SO4 =2Fe(OH) SO4 + Na2SO4 + 2NO↑
(3)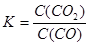 >
>
(4)B
(5)大于、 0.006 mol/(L·min)
【解析】
試題分析:(1)①根據電荷守恒可知:X=4,②由方程式可得:每生成1 mol Fe3O4,反應轉移的電子為4mol;
(2)工業上以FeSO4、NaNO2和稀硫酸為原料來制備Fe(OH)SO4的方程式為2FeSO4 + 2NaNO2 + H2SO4 =2Fe(OH) SO4 + Na2SO4 + 2NO↑。
(3)高爐煉鐵過程中發生的主要反應的化學平衡常數為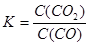 。由于升高溫度K減小,說明升高溫度化學平衡向逆反應方向移動,逆反應方向是吸熱反應,所以正反應為放熱反應,所以Q>0.
。由于升高溫度K減小,說明升高溫度化學平衡向逆反應方向移動,逆反應方向是吸熱反應,所以正反應為放熱反應,所以Q>0.
(4)A升高溫度化學平衡向逆反應方向移動,CO的平衡轉化率降低。錯誤。B移出部分CO2,即減小生成物的濃度,平衡向正反應方向移動,CO的平衡轉化率提高。正確。C.加入合適的催化劑 ,對化學平衡無影響,因此CO的平衡轉化率不變。錯誤。D.減小容器的容積即增大壓強。由于該反應是反應前后氣體體積相等的反應,所以改變壓強化學平衡不移動,CO的平衡轉化率不變。錯誤。故正確選項為B。
(5)在一個容積為10L的密閉容器中,1000℃時加入Fe、Fe2O3、CO、CO2各1.0 mol,因為C(CO) :C(CO2) =1<4.0,所以V正>V逆。C(CO) (開始)= 0.1mol/L, C(CO2)(開始) =0.1mol/L,假設在反應過程中ΔC(CO)=X,則平衡時C(CO) (平衡)=( 0.1-X) mol/L, C(CO2) (平衡)=( 0.1+X) mol/L,C(CO2) (平衡):C(CO) (平衡)= ( 0.1+X) mol/L:( 0.1-X) mol/L=4.0,解得X=0.06mol/L. 所以在該時間范圍內反應的平均反應速率v (CO2)= 0.06mol/L÷10L=0.006mol/(L·min).
考點:考查離子方程式的配平、氧化還原反應中的電子轉移、化學平衡常數的表達式、平衡狀態的判斷、外界條件對化學平衡的影響等知識。


科目:高中化學 來源: 題型:閱讀理解
 鎂、鋁、鐵及其化合物在生產和生活中有廣泛的應用.
鎂、鋁、鐵及其化合物在生產和生活中有廣泛的應用.| 實驗序號 | I | II | III |
| 加入鋼樣粉末的質量(g) | 2.812 | 5.624 | 8.436 |
| 生成氣體的體積(L)(標準狀況) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c(CO) |
| c(CO2) |

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
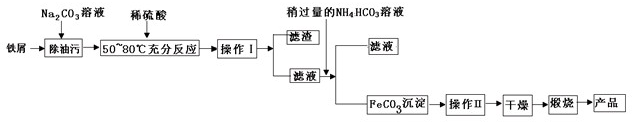
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012屆福建省莆田二中高三上學期期中考試化學試卷(帶解析) 題型:填空題
硅、鋁和鐵及其化合物在生產、生活中有廣泛應用。請回答下列問題:
(1)Al的原子結構示意圖為 ;Al與NaOH溶液反應的離子方程式為
。
(2)30Si原子的中子數為 ,Si的晶體類型為 。
(3)Al3+與Yn—的電子數相同,Y所在族各元素的氫化物的水溶液均顯酸性,則該族氫化物中沸點最低的是 。
(4)某焊藥熔渣36.0g(含Fe2O3、Al2O3、SiO2)加入足量稀鹽酸,分離得到11.0g固體,濾液中加入過量NaOH溶液,分離得到21.4g固體。則此熔渣中Al2O3的質量分數為
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com