
【題目】圖裝置中,U型管內為紅墨水,a、b試管內分別盛有食鹽水和氯化銨溶液,各加入生鐵塊,放置一段時間。下列有關描述錯誤的是
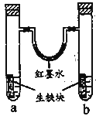
A.生鐵塊中的碳是原電池的正極
B.紅墨水柱兩邊的液面變為左低右高
C.兩試管中相同的電極反應式是:![]()
D.a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
科目:高中化學 來源: 題型:
【題目】已知:常溫下,pKa(HNO2)=-lgKa(HNO2)=3.37。在體積均為20mL、濃度均為0.1mol/L的HNO3溶液、HNO2溶液中滴加同濃度的NaOH溶液,溶液的導電離與NaOH溶液體積關系如圖所示。下列說法錯誤的是
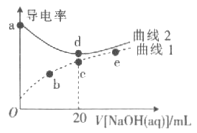
A.曲線1代表HNO2溶液
B.常溫下,c、d點溶液的pH都為7
C.加水稀釋b點溶液,水的電離程度增大
D.常溫下,a、e點溶液中Kw相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水是可以綜合利用的。從海水中提取食鹽和溴的過程如下:
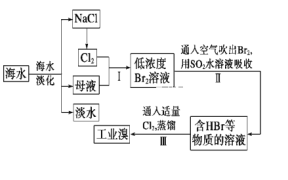
(1)請寫出一種海水淡化的方法:__。
(2)步驟Ⅰ獲取Br2的離子方程式為___。
(3)步驟Ⅱ用SO2水溶液吸收Br2,使溴蒸氣轉化為氫溴酸以達到富集的目的。其反應的化學方程式為Br2+SO2+2H2O=H2SO4+2HBr,在該反應中,氧化劑是__(填化學式)。若反應中生成2molHBr,則消耗___molSO2。
(4)根據上述反應判斷SO2、Cl2、Br2三種物質氧化性由強到弱的順序是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,下列五種溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水,⑤0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液(顯堿性)。請根據要求填寫下列空白:
(1)溶液①呈____________性(填“酸”、“堿”或“中”),其原因是___________(用離子方程式表示)
(2)在上述①、②、③、④溶液中c(NH4+)濃度由大到小的順序是_________。(填序號)
(3)在溶液⑤中,各離子濃度大小順序為___________。
(4)室溫下,測得溶液②的pH=7,則 CH3COO—與NH4+濃度的大小關系是c(CH3COO—)________c(NH4+)(填“>”、“<”或“=”)。
(5)常溫下,0.1 mol/ L CH3COOH溶液加水稀釋過程中,下列表達式的數值變大的是____________(填字母)。
A. c(H+) B. c(H+)/ c(CH3COOH) C. c(H+)·c(OH-)
D. c(OH-)/ c(H+) E. c(H+)·c(CH3COO-) / c(CH3COOH)
(6)25℃時,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗的敘述中正確的是( )
A.能夠使甲基橙變黃的溶液一定為堿性溶液
B.以KI溶液為標準溶液滴定未知濃度的FeCl3溶液,可選用淀粉溶液作為指示劑
C.使用量程為50mL的滴定管測量溶液體積時,開始時讀數為21.00mL,將滴定管中剩余液體全部放出,則所得溶液體積大于29.00mL
D.盛待測液的滴定管,第一次讀數,平視凹液面最低處,第二次仰視,則所測待測液濃度偏高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有機物F和高分子N的合成路線如圖所示:
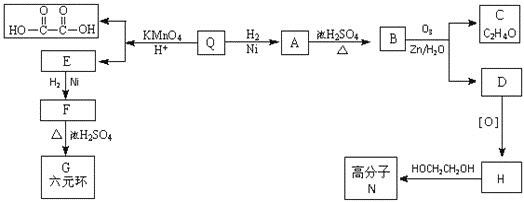
已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氫、氧三種元素,且其碳、氫、氧元素質量比為
只含碳、氫、氧三種元素,且其碳、氫、氧元素質量比為![]() ,經測定Q的相對分子質量是128。
,經測定Q的相對分子質量是128。![]() 可與
可與![]() 加成,并能與
加成,并能與![]() 恰好完全反應,且分子中無支鏈。Q的分子式是 ______________。
恰好完全反應,且分子中無支鏈。Q的分子式是 ______________。
![]() 所含官能團的名稱是 ___________、 _____________;
所含官能團的名稱是 ___________、 _____________;![]() 的反應類型是 ________________;
的反應類型是 ________________;
![]() 寫出C與銀氨溶液反應的化學方程式: _______________;
寫出C與銀氨溶液反應的化學方程式: _______________;
![]() 的結構簡式是 _______________;Q的反式結構簡式是 ____________。
的結構簡式是 _______________;Q的反式結構簡式是 ____________。
![]() 下列說法正確的是 _________________。
下列說法正確的是 _________________。
A. C能與苯酚在一定條件下生成高分子化合物
B. D催化加氫的產物與F互為同分異構體
C. F能發生氧化反應、取代反應、加成反應
D. 高分子N的每條分子鏈中含有![]() 個酯基
個酯基
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莫爾法是一種沉淀滴定法,以K2CrO4為指示劑,用標準硝酸銀溶液滴定待測液,進行測定溶液中Cl-的濃度。已知:
銀鹽 性質 | AgCl | AgBr | Ag2CrO4 |
顏色 | 白 | 淺黃 | 磚紅 |
滴定終點的現象是______,終點現象對應的離子反應方程式為______。為了測定產品中(NH4)2Cr2O7的含量,稱取樣品0.1500g,置于錐形瓶中,加50mL水,再加入2g KI(過量)及稍過量的稀硫酸溶液,搖勻,暗處放置10min,然后加150mL蒸餾水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3標準溶液滴定至終點,消耗Na2S2O3標準溶液30.00mL,則上述產品中(NH4)2Cr2O7的純度為______。(假定雜質不參加反應,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩爾質量為252g/mol)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】a、b、c、d 四種短周期元素在周期表中的位置如圖所示,a 和 b 分別位于周期表的第 2 列和第 13 列, 下列敘述正確的

A.離子半徑 b>d
B.b 可以和強堿溶液發生反應
C.c 的氫化物空間結構為三角錐形
D.a 的最高價氧化物對應水化物是強堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 以
以![]() 和
和![]() 為原料合成尿素是利用
為原料合成尿素是利用![]() 的成功范例。在尿素合成塔中的主要反應可表示如下:
的成功范例。在尿素合成塔中的主要反應可表示如下:
反應Ⅰ:![]()
![]()
反應Ⅱ:![]()
![]()
總反應:![]()
![]()
請回答下列問題:
![]() 反應Ⅰ的
反應Ⅰ的![]() ______________。
______________。
![]() 在____
在____![]() 填“高溫”或“低溫”
填“高溫”或“低溫”![]() 情況下有利于反應Ⅱ的自發進行。
情況下有利于反應Ⅱ的自發進行。
![]() 氨法溶浸氧化鋅煙灰制取高純鋅的工藝流程如圖所示。溶浸后氧化鋅煙灰中鋅、銅、鎘、砷元素分別以
氨法溶浸氧化鋅煙灰制取高純鋅的工藝流程如圖所示。溶浸后氧化鋅煙灰中鋅、銅、鎘、砷元素分別以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

![]() “溶浸”中 ZnO發生反應的離子方程式為 _______。
“溶浸”中 ZnO發生反應的離子方程式為 _______。
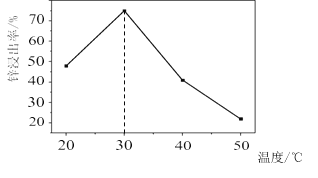
![]() 鋅浸出率與溫度的關系如圖所示,分析
鋅浸出率與溫度的關系如圖所示,分析 ![]() 時鋅浸出率最高的原因為 __________。
時鋅浸出率最高的原因為 __________。
![]() “濾渣 3”的主要成分為_______________。
“濾渣 3”的主要成分為_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com