
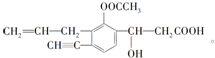
 +NaHCO3→
+NaHCO3→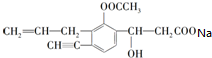 +CO2↑+H2O.
+CO2↑+H2O. 分析 (1)根據結構簡式知,其分子式為C16H16O5;
(2)該分子中含有碳碳三鍵、碳碳雙鍵、酯基、醇羥基、羧基;
(3)該物質中的羧基能和碳酸氫鈉反應生成二氧化碳、水和羧酸鈉.
解答 解:(1)根據結構簡式知,其分子式為C16H16O5,故答案為:C16H16O5;
(2)根據圖片知,該分子中含有碳碳三鍵、碳碳雙鍵、酯基、醇羥基、羧基,其含氧官能團是酯基、羥基、羧基,
故答案為:酯基、羥基和羧基;
(3)該物質中的羧基能和碳酸氫鈉反應生成二氧化碳、水和羧酸鈉,反應方程式為 +NaHCO3→
+NaHCO3→ +CO2↑+H2O,
+CO2↑+H2O,
故答案為: +NaHCO3→
+NaHCO3→ +CO2↑+H2O.
+CO2↑+H2O.
點評 本題考查有機物結構和性質,為高考高頻點,側重考查碳碳不飽和鍵、酯基、醇羥基和羧基,明確官能團及其性質的關系即可解答,題目難度不大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:填空題
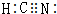 ,HCN中C元素的化合價為+2價.
,HCN中C元素的化合價為+2價.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
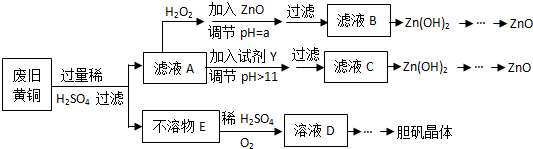
| Fe3+ | Fe2+ | Zn2+ | |
| 開始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Cl2能與金屬活動順序表中大多數金屬反應 | |
| B. | 待測溶液中加入氯化鋇溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根離子 | |
| C. | 在用AgNO3溶液檢驗Cl-時,一般先在被檢測的溶液中滴入少量的稀硝酸使其酸化,以排除干擾離子 | |
| D. | 硅是應用廣泛的半導體材料,常溫下化學性質不活潑,是光導纖維的主要成分 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘乙烷水解實驗后,取水解液,加入AgNO3溶液,檢驗鹵素離子 | |
| B. | 碘乙烷水解實驗后,取水解液,加入KMnO4(H+)溶液,檢驗產物乙醇 | |
| C. | 碘乙烷消去實驗后,將氣體導入KMnO4(H+)溶液,檢驗產物乙烯 | |
| D. | 碘乙烷消去實驗后,將氣體導入Br2(CCl4)溶液,檢驗產物乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化氮中混有一氧化氮雜質,可通入氧氣將一氧化氮轉化為二氧化氮 | |
| B. | 過量的銅與濃硝酸反應一定有一氧化氮生成 | |
| C. | Fe與S混合加熱生成FeS2 | |
| D. | 工業上利用氨氣制硝酸屬于人工固氮 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com