利用N
2和H
2可以實現NH
3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
(1)已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ?mol
-1N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ?mol
-12H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ?mol
-1若有17g氨氣經催化氧化完全生成一氧化氮氣體和水蒸氣所放出的熱量為______;
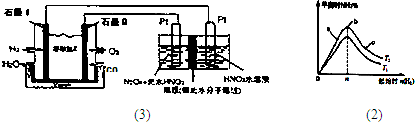
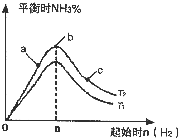
(2)某科研小組研究在其他條件不變的情況下,改變起始物氫氣的物質的量對N
2(g)+3H
2(g)?2NH
3(g)反應的影響,實驗結果如圖2所示:(圖中T表示溫度,n表示物質的量)
①圖象中T
1和T
2的關系是:T
1______T
2(填“>”、“<”、“=”或“無法確定”)
②比較在a、b、c三點所處的平衡狀態中,反應物N
2的轉化率最高的是______(填字母標號),
③在起始體系中加入N
2的物質的量為______mol時,反應后氨的百分含量最大.若容器容積為1L,n=3mol反應達到平衡時H
2的轉化率為60%,則此條件下(T
2),反應的平衡常數K=______;
(3)N
2O
3是一種新型硝化劑,其性質和制備受到人們的關注.
①一定溫度下,在恒容密閉容器中N
2O
3可發生下列反應:2N
2O
3?4NO
2(g)+O
2△H>0下表為反應在某溫度下的部分實驗數據則50s內NO
2的平均生成速率為______
| V/s |
0 |
50 |
100 |
| c(N2O3)/mol?L-1 |
5.00 |
3.52 |
2.48 |
②現以H
2、O
2、熔融鹽Na
2CO
3組成的燃料電池,采用電解法制備N
2O
3,裝置如圖1所示,其中Y為CO
2.寫出石墨I電極上發生反應的電極反應式______




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題: 利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題: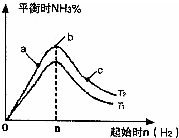 利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題: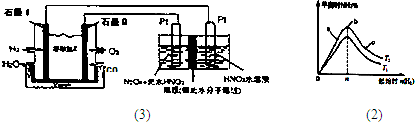
 利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題: