
 A、B、D、E、F五種元素的原子序數依次增大,除F為過渡元素外,其余四種均是短周期元素.已知:
A、B、D、E、F五種元素的原子序數依次增大,除F為過渡元素外,其余四種均是短周期元素.已知:分析 A、B、D、E、F五種元素的原子序數依次增大,除F為過渡元素外,其余四種均是短周期元素.
①F的單質為生活中最常見的金屬之一,原子最外層有2個電子,則F為Fe元素;
③A、D原子p軌道的電子數分別為2和4,則A核外電子排布式為1s22s22p2,則A為碳元素;D核外電子排布式為1s22s22p4,則D為氧元素.
B元素原子序數介于碳元素與氧元素之間,則B為氮元素;
②E原子價電子(外圍電子)排布為msnmpn,s能級容納2個電子,則E的價電子排布為為ms2mp2,原子序數大于氧元素,則E為Si元素.
據此結合元素化合物的性質和元素周期律解答.
解答 解:A、B、D、E、F五種元素的原子序數依次增大,除F為過渡元素外,其余四種均是短周期元素.
①F的單質為生活中最常見的金屬之一,原子最外層有2個電子,則F為Fe元素;
③A、D原子p軌道的電子數分別為2和4,則A核外電子排布式為1s22s22p2,則A為碳元素;D核外電子排布式為1s22s22p4,則D為氧元素.
B元素原子序數介于碳元素與氧元素之間,則B為氮元素;
②E原子價電子(外圍電子)排布為msnmpn,s能級容納2個電子,則E的價電子排布為為ms2mp2,原子序數大于氧元素,則E為Si元素.
(1)F為Fe元素,Fe的穩定價態離子Fe3+的電子排布式是1s22s22p63s23p63d5;同周期主族元素從左到右第一電離能增大,但是第IIA和第IIIA,第VA和第VIA族反常,同主族從上到下第一電離能減小,所以C、N、O、Si的第一電離能由大到小的順序為Si<C<O<N;
故答案為:1s22s22p63s23p63d5;Si<C<O<N;
(2)B為氮元素,其氫化物為NH3,NH3中N原子的雜化類型為sp3;分子的空間構型為三角錐型;NH3與H2O分子間易形成氫鍵,所以氨氣易溶于水;
故答案為:sp3;三角錐型;NH3與H2O分子間易形成氫鍵;
(3)兩種非金屬元素的電負性差別越大,形成的共價鍵的極性就越大,O與C、N形成的共價鍵中C-O的極性大;
故答案為:C-O;
(4)A為C元素,D為O元素,黑球可以形成4個共價鍵,所以黑球為C,白球為O;
a.黑球在頂點、面心和晶體內部,黑球個數為$\frac{1}{8}×8+\frac{1}{2}×6+4$=8,白球全部在晶胞內部有16個,所以晶體的化學式為AD2,故a錯誤;
b.該晶體中有的黑球連接4個白球,有的連接2個白球,所以A、D原子間形成的是單鍵和雙鍵,故b錯誤;
c.該晶體為空間網狀結構,為原子晶體,C原子半徑小于Si,所以熔點可能比SiO2晶體高,故c正確;
d.該晶體為原子晶體,原子晶體難溶于水,故d錯誤.
故答案為:c.
點評 本題考查結構性質位置關系、電子排布式、化學鍵、晶胞結構與計算等,側重于學生的分析能力和計算能力的考查,難度中等,推斷元素是解題關鍵,注意利用均攤法進行晶胞的計算.


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南師范大學出版社系列答案
同步練習西南師范大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 分液、萃取、蒸餾 | B. | 分液、蒸餾、萃取 | C. | 萃取、蒸餾、分液 | D. | 蒸餾、萃取、分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
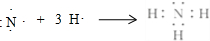 ;
;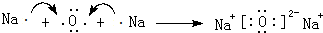 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 固態>液態>氣態 | B. | 液態>固態>氣態 | C. | 氣態>液態>固態 | D. | 氣態>固態>液態 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
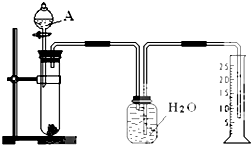 某同學設計了一個簡單的實驗(如圖所示),以測定鎂鋁合金中鋁的質量分數.可供選用的試劑有:濃H2SO4、濃硝酸、6mol•L-1NaOH溶液.請填寫下列空白:
某同學設計了一個簡單的實驗(如圖所示),以測定鎂鋁合金中鋁的質量分數.可供選用的試劑有:濃H2SO4、濃硝酸、6mol•L-1NaOH溶液.請填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸發結晶操作時,當有大量晶體析出時停止加熱,用余熱蒸干 | |
| B. | 蒸餾操作時,應使溫度計水銀球插入液態混合物中 | |
| C. | 分液操作時,分液漏斗中下層液體從下口流出,上層液體從上口倒出 | |
| D. | 萃取操作時,萃取劑要和原溶劑互不相溶,且不能與溶質和溶劑反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 正極反應式為KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在該熱電池中,鐵為負極,發生還原反應 | |
| C. | △H參與反應的高氯酸鉀越多,其值越小 | |
| D. | 生成1 mol FeO轉移8 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com