
分析 (1)化學反應速率v=$\frac{△c}{△t}$來計算反應速率,根據影響化學平衡移動的因素來回答判斷;
(2)根據蓋斯定律計算化學反應的焓變;
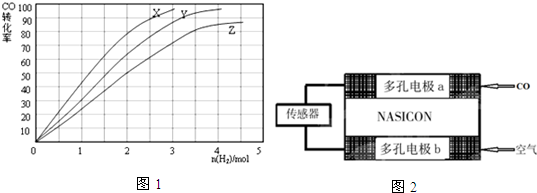
(3)合成甲醇是放熱反應,升高溫度平衡逆向移動,CO的轉化率減小,則230℃時的實驗結果所對應的曲線是X,270℃對應的曲線是Z,加入氫氣為2mol時,CO轉化率為50%,計算平衡時各組分的物質的量,容器的體積為1L,用物質的量代替濃度代入平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$計算;
(4)該裝置是原電池,負極上一氧化碳失電子發生氧化反應,電極反應式為CO-2e-+O2-═CO2,正極上氧氣得電子發生還原反應,原電池放電時電子從負極流向正極,陰離子向負極移動,一氧化碳的含量越大,原電池放電時產生的電流越大.
解答 解:(1)5min內CO的平均化學反應速率v=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{1L}}{5min}$=0.02mol/(L•min),甲烷表示的平均反應速率和一氧化氮的是相等的,即為0.02mol/(L•min),根據反應CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ•mol-1,
a.加熱升高溫度,化學平衡正向移動,所以一氧化碳濃度增加,甲烷濃度減小,所以比值會增大,故a正確;
b.恒溫恒容下充入氦氣,各組分的濃度不變,所以平衡不移動,比值不變,故b錯誤;
c.恒溫下增大容器體積則壓強減小,化學平衡正向移動,所以一氧化碳濃度增加,甲烷濃度減小,所以比值會增大,故c正確;
d.恒溫恒容下再充入等物質的量的CH4和H2O,相當于增大壓強,化學平衡逆向動,所以一氧化碳濃度減小,甲烷濃度增加,所以比值會減小,故d錯誤;故選ac,
故答案為:0.02mol/(L•min);ac;
(2)已知①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1
則①-②得CO(g)+2H2(g)?CH3OH(l)△H=(-49.5kJ•mol-1 )-41.3kJ/mol)=-90.8kJ•mol-1,
故答案為:CO(g)+2H2(g)?CH3OH(l)△H=-90.8 kJ•mol-1;
(3)合成甲醇是放熱反應,升高溫度平衡逆向移動,CO的轉化率減小,則230℃時的實驗結果所對應的曲線是X,270℃對應的曲線是Z,加入氫氣為2mol時,CO轉化率為50%,則:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 2 0
變化量(mol):0.5 1 0.5
平衡量(mol):0.5 1 0.5
容器的體積為1L,用物質的量代替濃度計算,則平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,
故答案為:$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1;
(4)該裝置是原電池,負極上一氧化碳失電子發生氧化反應,電極反應式為CO-2e-+O2-═CO2,
a.工作時電極b通入空氣,b作正極,陰離子向負極移動,O2-由電極b流向電極a,故a正確;
b.原電池放電時電子從負極流向正極,故電流由電極b通過傳感器流向電極a,故b錯誤;
c.一氧化碳的含量越大,原電池放電時產生的電流越大,故c正確,
故答案為:CO-2e-+O2-═CO2;ac.
點評 本題考查化學平衡計算及影響因素、平衡常數、速率計算、熱化學方程式書寫、原電池原理等,旨在考查學生對基礎知識的理解運用,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ②③⑤⑥⑦⑧ | C. | ④⑤⑥⑦⑧ | D. | ①②③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用澄清石灰水鑒別CO2和SO2 | |
| B. | 用濕潤的碘化鉀淀粉試紙鑒別Br2(g)和NO2 | |
| C. | 用CO2鑒別Na[Al(OH)4]溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鑒別Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 纖維素 滌綸 | B. | 麥芽糖 胰島素 | ||
| C. | 聚乙烯 酚醛樹脂 | D. | 淀粉 聚異戊二烯 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com