
【題目】在一固定體積的密閉容器中,充入2 mol CO2和1 mol H2發生如下化學反應:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化學平衡常數與溫度(T)的關系如下表:
CO(g)+H2O(g),其化學平衡常數與溫度(T)的關系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列問題:
(1)該反應的化學平衡常數表達式為K=_________________。
(2)若反應在830 ℃下達到平衡,則CO2氣體的轉化率為________。
(3)若絕熱時(容器內外沒有熱量交換),平衡發生移動的結果是使容器內CO的濃度增大,則容器內氣體溫度________(填“升高”、“降低”或“不能確定”)。
(4)能判斷該反應是否達到化學平衡狀態的依據是____________。
A 容器內壓強不變 B 混合氣體中c(CO)不變
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)當發動機采用稀薄燃燒時,尾氣中的主要污染物為NOx,可用CxHy(烴)催化還原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=_____________。
【答案】c(CO)c(H2O)/c(CO2)c(H2) 33.3% 降低 BC -1160 kJ·mol-1
【解析】
(1) 化學平衡常數K等于生成物濃度冪之積與反應物濃度冪之積的比,所以K= c(CO)·c(H2O)/c(CO2)·c(H2) ;答案:K=c(CO)·c(H2O)/c(CO2)·c(H2)。
(2)若反應在830 ℃下達到平衡,該反應平衡常數K=1.0,該反應中各物質計量數相等且反應前后氣體計量數之和不變,該反應化學平衡常數也等于平衡時生成物物質的量之積與反應物物質的量之積的比, 設參加反應的二氧化碳物質的量為xmol,
CO2(g)+H2(g)![]() CO(g)+H2O(g) ,
CO(g)+H2O(g) ,
開始(mol) 2 1 0 0
反應(mol) x x x x
平衡(mol) 2-x 1-x x x
化學平衡常數K=x2/(2-x)![]() (1-x)=1,x=2/3。二氧化碳轉化率=參加反應的二氧化碳的物質的量/二氧化碳的總物質的量
(1-x)=1,x=2/3。二氧化碳轉化率=參加反應的二氧化碳的物質的量/二氧化碳的總物質的量![]() =
=![]() =33.3%,因此,本題正確答案是: 33.3%。
=33.3%,因此,本題正確答案是: 33.3%。
(3)根據表中數據知,升高溫度,平衡常數增大,則該反應的正反應是吸熱反應;若絕熱時(容器內外沒有熱量交換),平衡發生移動的結果是使容器內CO的濃度增大,說明平衡正向移動,則容器內溫度降低,因此正確答案是: 降低。
(4)A.由 CO2(g)+H2(g)![]() CO(g)+H2O(g)知兩邊化學計量數相等,所以壓強是定值,故容器內壓強不變不能作為判斷平衡的依據,故A錯誤;B.混合氣體中c(CO)不變,說明反應達到平衡狀態,故B正確;C.v正(H2)=v逆(H2O)說明正逆反應速率相等,故C正確;D.c(CO2)和c(CO)濃度與初始加入量有關,c(CO2)=c(CO)不能作為判斷平衡的標志,故D錯誤;E.c(CO2 )·c(H2)=c(CO)·c(H2O) 不能作為判斷平衡的標志,與初始量和溫度有關,830 ℃時相等是平衡狀態,其他溫度下不等,故D錯誤;答案:B、C。
CO(g)+H2O(g)知兩邊化學計量數相等,所以壓強是定值,故容器內壓強不變不能作為判斷平衡的依據,故A錯誤;B.混合氣體中c(CO)不變,說明反應達到平衡狀態,故B正確;C.v正(H2)=v逆(H2O)說明正逆反應速率相等,故C正確;D.c(CO2)和c(CO)濃度與初始加入量有關,c(CO2)=c(CO)不能作為判斷平衡的標志,故D錯誤;E.c(CO2 )·c(H2)=c(CO)·c(H2O) 不能作為判斷平衡的標志,與初始量和溫度有關,830 ℃時相等是平衡狀態,其他溫度下不等,故D錯誤;答案:B、C。
(5)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1;②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1,根據蓋斯定律得: ②![]() -①:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=(-867
-①:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=(-867![]() 2)-(-574)kJ/mol=-1160 kJ·mol-1。答案:-1160 kJ·mol-1。
2)-(-574)kJ/mol=-1160 kJ·mol-1。答案:-1160 kJ·mol-1。


科目:高中化學 來源: 題型:
【題目】I.用相應的方程式解釋:
(1)NaHSO3溶液顯酸性:___________________
(2)NaHCO3溶液顯堿性:____________________
(3)NH4Cl溶液顯酸性:______________________
(4)明礬[KAl(SO4)2]凈水:___________________
(5)FeCl3溶液蒸干得到Fe2O3固體:____________(第一步反應)
II.向2份0.1mol/LCH3COONa溶液中分別加入少量NH4NO3、Na2CO3固體(忽略溶液體積變化),則CH3COO-濃度的變化依次為_______、______(填“減小”、“增大”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題。
下列物質組別中①互為同位素的是___(填組別選項,下同);②互為同素異形體的是___;③互為同分異構體的是___;④屬于同一物質的是___;⑤屬于同系物的是___。
A.冰與水B.H2、D2、T2C.O2與O3D.![]() K與
K與![]() KE.CH3—CH2—CH2—CH3與
KE.CH3—CH2—CH2—CH3與 F.
F. 與
與 G.甲烷和庚烷
G.甲烷和庚烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,濃度均為0.1 mol/L的HA溶液和BOH溶液,pH分別是1和11。下列說法正確的是( )
A. BOH溶于水,其電離方程式是BOH===B++OH-
B. 若一定量的上述兩溶液混合后pH=7,則c(A-)=c(B+)
C. 在0.1 mol/L BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D. 若將0.1 mol/L BOH溶液稀釋至0.001 mol/L,則溶液的pH=9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示。己知0.10mol·L-1氨水的電離度為1.32%,下列有關敘述正確的是

A. 該滴定過程應該選擇酚酞作為指示劑
B. M點對應的鹽酸體積為20.0mL
C. M點處的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N點處的溶液中pH<12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據反應:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)設計的原電池如下圖所示。

請回答下列問題:
(1)電極X的材料是___________,電解質溶液Y是___________;
(2)銀電極為電池的___________極,發生的電極反應為___________;X電極上發生的電極反應為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于價電子構型為3s23p4的粒子描述正確的是( )
A. 它的元素符號為O
B. 它的核外電子排布式為1s22s22p63s23p4
C. 它可與H2生成固態化合物
D. 其基態電子排布圖為: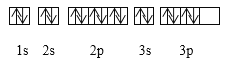
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】天然維生素P(結構如圖,其中烴基R為飽和烴基)存在于槐樹花蕾中,它是一種營養增補劑。關于維生素P的敘述錯誤的是 ( )
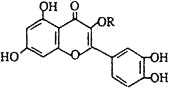
A. 可以使酸性KMnO4溶液褪色
B. 分子中有三個苯環
C. 1mol維生素P可以和4molNaOH反應
D. 維生素P與溴水反應時1mol維生素P可以消耗6molBr2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“暖冰”是韓國首爾大學科學家將水置于一個足夠強的電場中,在20℃時,水分子瞬間凝固形成的.某老師在課堂上做了一個如圖所示的實驗,發現燒杯中酸性KMnO4溶液褪色.若將燒杯中的溶液換成含有少量KSCN的FeCl2溶液,則溶液呈血紅色.則下列說法中不正確的是( )
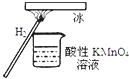
A. 在電場作用下,水分子間更易形成氫鍵,因而可以制得“暖冰”
B. 水凝固形成20℃時的“暖冰”所發生的變化是化學變化
C. 該條件下H2燃燒生成了既具有氧化性又具有還原性的物質
D. 該條件下H2燃燒的產物中可能含有一定量的H2O2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com