
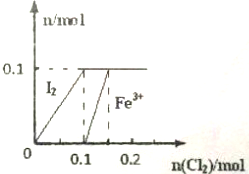
 某實驗小組向100mL FeI2溶液中逐漸通入Cl2,會依次發生如下反應:
某實驗小組向100mL FeI2溶液中逐漸通入Cl2,會依次發生如下反應:分析 (1)根據圖象,結合反應Cl2+FeI2=FeCl2+I2 知,當通入0.1molCl2時碘離子完全被氧化生成碘單質,碘化亞鐵的物質的量是0.1mol,結合方程式計算生成的;
(2)當溶液中n(Cl-):n(IO3-)=10:1時,Fe2+全部被氧化為Fe3+,由(1)可知碘化亞鐵的物質的量是0.1mol,設碘酸根的物質的量是x,則氯離子的物質的量是10x,根據氧化還原反應中得失電子數相等計算x,再根據原子守恒計算出消耗的氯氣.
解答 解:(1)根據圖象,結合反應Cl2+FeI2=FeCl2+I2 知,當通入0.1molCl2時碘離子完全被氧化生成碘單質,碘化亞鐵的物質的量是0.1mol,
剩余的0.03molCl2與Fe2+反應生成Fe3+,由Cl2+2Fe2+═2Cl-+2Fe3+可知0.03molCl2消耗0.06molFe2+,生成0.06molFe3+,則溶液中剩余0.04molFe2+,
故答案為:0.04molFe2+,0.06molFe3+;
(2)當溶液中n(Cl-):n(IO3-)=10:1時,碘離子轉化為碘酸根離子時,Fe2+全部被氧化為Fe3+,由(1)可知碘化亞鐵的物質的量是0.1mol,
設碘酸根的物質的量是x,則氯離子的物質的量是10x,根據氧化還原反應中得失電子數相等得x×6+(0.2-x)×1+0.1×1=10x×1,x=0.06,所以溶液中碘酸根的物質的量是0.06mol,氯離子的物質的量是0.6mol,根據Cl2~2Cl-知,氯氣的物質的量是0.3mol,氯氣的體積=0.3mol×22.4L/mol=6.72L,
故答案為:6.72.
點評 本題考查了氧化還原反應、有關化學方程式的計算,題目難度中等,側重于考查學生的計算能力和分析能力,注意原子守恒和電子守恒在計算中的應用.


科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ①③④⑥ | C. | ③④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入硝酸酸化的Ba(NO3)2 | B. | 先加HNO3酸化,再加Ba(NO3)2溶液 | ||
| C. | 先加鹽酸酸化,再加BaCl2溶液 | D. | 加入鹽酸酸化了的BaCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaO中混有CaCO3(高溫煅燒) | B. | CO混有CO2(石灰水) | ||
| C. | H2中混有HCl(NaOH溶液) | D. | Ca(OH)2中混有CaCO3(鹽酸) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
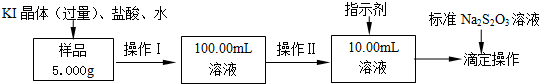
查看答案和解析>>
科目:高中化學 來源:2017屆海南省高三上學期月考三化學試卷(解析版) 題型:實驗題
空氣 吹出法工藝,是目前“海水提溴”的最主要方法之一。其工藝流程如下:
吹出法工藝,是目前“海水提溴”的最主要方法之一。其工藝流程如下:
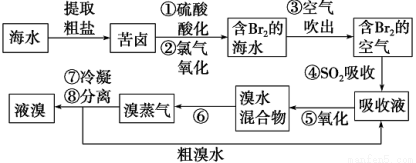
(1)步驟①中用硫酸酸化的目的是 ;
步驟②發生反應的離子方程式為 。
(2)步驟④利用了SO2的還原性,反應的離子方程式: 。
(3)步驟⑥的名稱是 。
(4)從含Br2的海水中吹出的溴也可用純堿吸收,純堿吸收溴的主要反應是3Na2CO3+3Br2==NaBrO3+5NaBr+3CO2;吸收1 mol Br2時,轉移的電子為_________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 集氣瓶被譽為“萬能瓶”,如下圖裝置是其中的一種.當被收集的氣體從a口進入時,瓶內空氣從b口排出,相當于向上排空氣法收集氣體.現若將被收集的氣體從b口進入,則它可收集的氣體為:①H2 ②O2 ③CO2( )
集氣瓶被譽為“萬能瓶”,如下圖裝置是其中的一種.當被收集的氣體從a口進入時,瓶內空氣從b口排出,相當于向上排空氣法收集氣體.現若將被收集的氣體從b口進入,則它可收集的氣體為:①H2 ②O2 ③CO2( )| A. | 只有① | B. | 只有②和③ | C. | 只有③ | D. | ①②③均可 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com