
【題目】根據價層電子對互斥理論,中心原子雜化軌道類型為sp2的微粒為( )
A. CH3ClB. SO32﹣C. NF3D. CO32﹣
【答案】D
【解析】
根據雜化軌道數判斷雜化類型,雜化軌道數=價層電子對=σ 鍵電子對+中心原子上的孤電子對,σ鍵個數=配原子個數,孤電子對個數=![]() ,a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數,據此判斷雜化類型。
,a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數,據此判斷雜化類型。
A.CH3Cl中C形成4個σ鍵,無孤電子對,中心C原子為sp3雜化,A錯誤;
B.SO32-離子中的S形成3個σ 鍵,孤電子對數=![]() =1,價層電子對個數=3+1=4,則中心原子S雜化類型是sp3,B錯誤;
=1,價層電子對個數=3+1=4,則中心原子S雜化類型是sp3,B錯誤;
C.NF3分子中價層電子對個數=3+![]() =4,中心原子N原子雜化類型分別為sp3,C錯誤;
=4,中心原子N原子雜化類型分別為sp3,C錯誤;
D. CO32﹣中價層電子對個數=3+![]() =3,中心原子N原子雜化類型分別為sp2,D正確;
=3,中心原子N原子雜化類型分別為sp2,D正確;
故合理選項是D。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】為有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物、碳氧化物和硫氧化物含量顯得尤為重要。
(1)已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol;
②CO的燃燒熱為283.0 kJ/mol。
則2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=________kJ/mol。
(2)在恒溫、恒容條件下,將2.0 mol NO和1.0 mol CO充入一個容積為2 L的密閉容器中發生上述反應,反應過程中部分物質的物質的量(n)變化如圖所示。
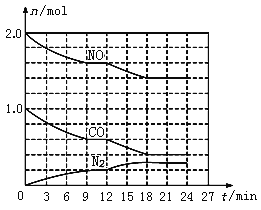
①N2在0~9 min內的平均反應速率v(N2)=________mol/(Lmin);
②第9 min時氮氣的產率為________;
③第12 min時改變的反應條件可能為_______(填字母代號);
A.升高溫度 B.加入NO C.加催化劑 D.減小壓強 E.降低溫度
④若在第24min將NO與N2的濃度同時增加到原來的2倍,化學平衡______移動(填“向正反應方向”、“逆反應方向”或“不”)。
(3)若將反應容器改為恒溫容積可變的恒壓密閉容器,壓強為P=3.0MPa,反應物加入的物質的量不變,達到平衡時CO的轉化率為50%,該溫度下此反應平衡常數Kp=______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高分子化合物G是一種聚酯材料,其一種合成路線如下:

回答下列問題:
(1)A的名稱是________,B含有的官能團名稱是________。
(2)反應④的反應類型是________。
(3)反應⑥的化學方程式為________。
(4)反應③⑤中引入-SO3H的作用是________。
(5)滿足下列條件的C的同分異構體共有________種(不含立體異構)。
①能使FeCl3溶液顯紫色;能發生水解反應。②苯環上有兩個取代基。
其中核磁共振氫譜顯示為5組峰,峰面積之比為3:2:2:2:1,且含有-CH2CH3,該有機物的結構簡式是________ (任寫一種)。
(6)以CH3CH2CH2OH為原料,設計制備 的合成路線:________。
的合成路線:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環氧乙烷(![]() )是一種最簡單的環醚,常用于有機合成。某研究小組以環氧乙烷和甲苯為原料按下列流程合成有機化合物G和I。
)是一種最簡單的環醚,常用于有機合成。某研究小組以環氧乙烷和甲苯為原料按下列流程合成有機化合物G和I。
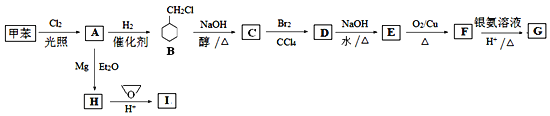
已知:CH3Cl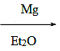 CH3MgCl
CH3MgCl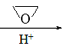 CH3CH2CH2OH
CH3CH2CH2OH
回答下列問題:
(1)A分子中最多有_____個原子共平面。
(2)D的結構簡式為_____。
(3)寫出下列反應的化學方程式:
E→F:______;G和I在濃硫酸催化下生成酯:______。
(4)I有多種同分異構體,寫出其中滿足以下條件的同分異構體的結構簡式:_______。
①屬于芳香族化合物; ② 能與FeCl3溶液發生顯色反應;
③核磁共振氫譜顯示不同環境的氫原子個數比1:2:3:6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環戊二烯( )是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
)是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
對于反應:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某溫度下,等物質的量的碘和環戊烯(![]() )在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
)在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
A.通入惰性氣體 B.提高溫度
C.增加環戊烯濃度 D.增加碘濃度
(3)環戊二烯容易發生聚合生成二聚體,該反應為可逆反應。不同溫度下,溶液中環戊二烯濃度與反應時間的關系如圖所示,下列說法正確的是__________(填標號)。

A.T1>T2
B.a點的反應速率小于c點的反應速率
C.a點的正反應速率大于b點的逆反應速率
D.b點時二聚體的濃度為0.45 mol·L1
(4)環戊二烯可用于制備二茂鐵(Fe(C5H5)2結構簡式為 ),后者廣泛應用于航天、化工等領域中。二茂鐵的電化學制備原理如下圖所示,其中電解液為溶解有溴化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑)。
),后者廣泛應用于航天、化工等領域中。二茂鐵的電化學制備原理如下圖所示,其中電解液為溶解有溴化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑)。

該電解池的陽極為____________,總反應為__________________。電解制備需要在無水條件下進行,原因為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)Fe(CO)5中鐵的化合價為0,寫出鐵原子的簡化的基態電子排布式______,Fe在周期表中第______周期______族,屬于_______區。
(2)已知Fe(CO)5常溫下呈液態,熔點為﹣20.5 ℃,沸點為103 ℃,易溶于非極性溶劑,據此可判斷Fe(CO)5晶體為________(填晶體類型)。
(3)金屬鐵單質的晶體在不同溫度下有兩種堆積方式,晶胞分別如下圖所示。
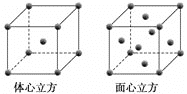
體心立方晶胞和面心立方晶胞中實際含有的鐵原子個數之比為________;Fe原子配位數之比為____。若兩種晶體中最鄰近的鐵原子間距離相同,則體心立方晶胞和面心立方晶胞密度之比為_______。
(4)已知:Y原子最高價氧化物對應水化物的酸性最強。銅與Y形成化合物的晶胞如圖所示(黑點代表銅原子,空心圓代表Y原子)。
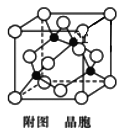
①該晶體的化學式為________。(用元素符號表示)
②已知該晶體的密度為ρ g/cm3,阿伏加德羅常數為NA,則該晶胞邊長為______nm(只寫計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
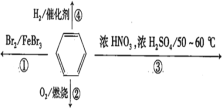
A.反應①為取代反應,有機產物與水混合后有機產物浮在上層
B.反應②為氧化反應,反應現象是火焰明亮并帶有濃煙
C.反應③為取代反應,有機產物是一種烴類
D.一個苯分子含有三個碳碳雙鍵,反應④中1mol苯最多與3molH2發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的捕捉、封存與再利用是實現溫室氣體減排的重要途徑之一。
(1)二氧化碳的電子式為___________。
(2)下列利用二氧化碳的反應中原子利用率達100%的是_____(填序號)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.
(3)一種正在開發的利用二氧化碳制取甲醇的流程如下:

①反應(Ⅰ)將CO2和H2O轉化為甲酸常用途徑有兩種,如下圖(a)和 (b)。

圖(a)中能量主要轉化方式為____,圖(b)中發生反應的化學方程式為_____。
②在5L的恒溫恒容密閉容器中充入1moLCO和4molH2,加入催化劑發生反應,測得CO及CH3OH的物質的量隨時間變化如下圖所示。

圖中第______min(填數字)反應達到平衡,CO在0~4min內的平均反應速率比在4~8min內的快,其原因是______;達到平衡時氫氣的濃度為______。
(4)已知斷裂(或生成)1mol化學鍵吸收(或放出)的能量稱為鍵能,反應H2(g)+ I2(g)=2HI(g)相關鍵能數據如下:
化學鍵 | H—I | H—H | I—I |
鍵能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
則該反應的△H為_________kJ·mol-1。
(5)氨氣可作為脫硝劑,在恒溫恒容密閉容器中充入一定量的NO和NH3,在一定條件下發生反應:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能說明該反應已達到平衡狀態的標志是_________(不定項選擇)。
a.反應速率v( NH3) =v( N2)
b.容器內壓強不再隨時間而發生變化
c.容器內N2的物質的量分數不再隨時間而發生變化
d.容器內n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次實驗中測得容器內NO及N2的物質的量隨時間變化如下圖所示,圖中v(正)與v(逆)相等的點為______(選填字母)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com