
【題目】在某溫度下可逆反應:Fe2(SO4)3+6KSCN![]() 2Fe(SCN)3+3K2SO4達到平衡狀態后加入少量下列何種固體物質,該平衡幾乎不發生移動( )
2Fe(SCN)3+3K2SO4達到平衡狀態后加入少量下列何種固體物質,該平衡幾乎不發生移動( )
A. NH4SCN B. K2SO4 C. NaOH D. FeCl3·6H2O
 巧學巧練系列答案
巧學巧練系列答案科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G是短周期元素,周期表中B與C相鄰,C與E同主族;A中L層是K層的2倍,B的電子數比C的電子數少1個;F元素的原子在周期表中半徑最小;常見化合物D2C2與水反應生成C的氣體單質,且溶液使酚酞溶液變紅。G是第三周期原子半徑最小的主族元素。
(1)B在元素周期表的位置_____ ;A、B、C的氫化物穩定性順序為_______(用分子式表示);G的陰離子的還原性_____(大于或小于)E的陰離子。
(2)F2C和F2E中,沸點較高的是____(填化學式),其主要原因是_____。
(3)B與F元素可形成18電子分子的電子式為_____。
(4)D的最高價氧化物的水化物的電子式____,用電子式表示FGC的形成過程為_______;
(5)錫(Sn)是古代五金之一,在第五周期第ⅣA,錫能和濃硫酸反應生成Sn(SO4)2和刺激性氣味氣體,反應的化學方程式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在甲、乙、丙、丁四個恒容密閉容器中投入H2和I2,發生反應:H2(g)+I2(g) ![]() 2HI(g)。反應體系中各物質濃度的有關數據如下。
2HI(g)。反應體系中各物質濃度的有關數據如下。
容器 | 起始濃度 | 平衡濃度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判斷不正確的是
A. HI的平衡濃度:a=b>0.004,c=0.008 B. 平衡時,H2的轉化率:丁>甲
C. 平衡時,乙中H2的轉化率大于20% D. 丙中條件下,該反應的平衡常數K=0.25
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2 mol某金屬單質與足量的鹽酸反應,放出67.2L H2(標準狀況),并轉變為具有Ne原子電子層結構的離子,該金屬元素在元素周期表中的位置是
A. 第三周期第ⅠA族B. 第三周期第ⅡA族
C. 第三周期第ⅢA族D. 第四周期第ⅢA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己知氨基酸可發生如下反應:
![]()
D、E的相對分子質量分別為162和144,可發生如下物質轉化關系。如下圖所示:

(1)寫出B、D的結構簡式:B________,D_________。
(2)寫出C→E的化學方程式:_________________。
(3)寫出C→D的化學方程式:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25 ℃,,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
物質 | X | Y | Z |
初始濃度/(mol·L-1) | 1 | 2 | 0 |
平衡濃度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列說法錯誤的是( )
A. 反應達到平衡時,X的轉化率為40%
B. 反應可表示為X(g)+2Y(g) ![]() 2Z(g),其平衡常數為0.74
2Z(g),其平衡常數為0.74
C. 其它條件不變時,增大壓強能使平衡向生成Z的方向移動,平衡常數也增大
D. 改變溫度可以改變此反應的平衡常數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】控制適合的條件,將反應Fe3++AgFe2++Ag+設計成如下圖所示的原電池(鹽橋裝有瓊脂-硝酸鉀溶液;靈敏電流計的0刻度居中,左右均有刻度)。已知接通后,觀察到電流計指針向右偏轉。下列判斷不正確的是( )。
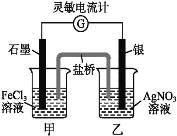
A. 在外電路中,電子從銀電極流向石墨電極
B. 鹽橋中的K+移向甲燒杯
C. 電流計指針居中后,往甲燒杯中加入一定量的鐵粉,電流計指針將向左偏轉
D. 一段時間后,電流計指針反向偏轉,越過0刻度,向左邊偏轉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】要除去氯氣中少量的HCl和水蒸氣,可將氣體依次通過
A.濃硫酸,飽和食鹽水B.NaOH溶液,濃硫酸
C.飽和食鹽水,堿石灰D.飽和食鹽水,濃硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X和Y可以形成XY4型化合物,若X的原子序數為a,Y的原子序數為b,則a和b的相互關系不可能是( )
A. a-13 = b
B. a +8 = b
C. b-11 = a
D. b+5 = a
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com