
硫酸鹽在生產生活中有廣泛應用。
Ⅰ.工業上以重晶石(主要成分BaSO4)為原料制備BaCl2,其工藝流程示意圖如下:
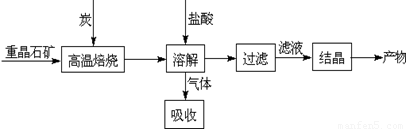
某研究小組查閱資料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1
①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1
①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1
②
2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1
②
(1)用過量NaOH溶液吸收氣體,得到硫化鈉。該反應的離子方程式是 。
(2)反應C(s)+CO2(g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)實際生產中必須加入過量的炭,同時還要通入空氣,其目的有兩個
①從原料角度看, ;
②從能量角度看,①②為吸熱反應,炭和氧氣反應放熱維持反應所需高溫。
(4)該小組同學想對BaSO4在水中的沉淀溶解平衡做進一步研究,查資料發現在某溫度時BaSO4在水中的沉淀溶解平衡曲線如圖所示。
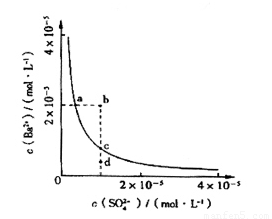
該小組同學提出以下四種觀點:
①當向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,則此時SO42-在溶液中的濃度為0
②加入Na2SO4可以使溶液由a點變到b點
③通過蒸發可以使溶液由d點變到c點
④d點無BaSO4沉淀生成
其中正確的是 (填序號)。
Ⅱ.某燃料電池以CaHSO4固體為電解質傳遞H+,其基本結構如圖所示,電池總反應可表示為2H2+O2═2H2O。
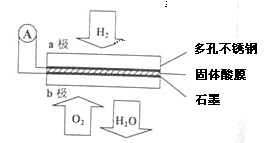
請回答:
(5)H+由 極通過固體酸電解質傳遞到另一極(填a或者b)。
(6)b極上發生的電極反應是 。
27.(12分,每空2分)
Ⅰ.(1)H2S+2OH- =2S2-+H2O
(2)+172.5 kJ•mol-1
(3)使BaSO4得到充分的還原,提高BaS的產量
(4)④
Ⅱ.(5)a
(6)O2+4e-+4H+═2H2O
【解析】
試題分析:
Ⅰ.(1)吸收的氣體是H2S,得到硫化鈉。該反應的離子方程式H2S+2OH- =2S2-+H2O 。
(2)根據蓋斯定律(①-②*2)/2=+172.5 kJ•mol-1
(3)使BaSO4得到充分的還原,提高BaS的產量
(4)① 無論如何SO42-在溶液中的濃度都不能為0,錯誤;
②加入Na2SO4可以使溶液由a點變到b點,相當于增加了SO42-的濃度,此時溶液中鋇離子濃度減小的,錯誤;
③ 通過蒸發可以使溶液由d點變到c點,無論是SO42-的濃度還是鋇離子濃度都是增加的,錯誤。
④d點中無論是SO42-的濃度還是鋇離子濃度都是比較小的,此時溶度積比離子積常數小,未能沉淀,所以正確的是④。
Ⅱ.(5)b電極是正極,氫離子在原電池中向正極移動,選a
(6)b電極是正極,發生還原反應,由于在酸性電解質中,故方程式為O2+4e-+4H+═2H2O
考點:考查離子方程式的書寫,熱化學方程式的計算和沉淀溶解平衡和原電池中電極反應方程式書寫等知識


科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
| 高溫 |
查看答案和解析>>
科目:高中化學 來源:2014屆遼寧省五校協作體高三(高二期末)摸底考試化學試卷(解析版) 題型:填空題
水是生命之源,水處理工藝在生產生活中占有重要地位。自來水生產的流程示意圖如下。(凈水劑亦稱混凝劑,常用的凈水劑有聚合氯化鋁、堿式氯化鋁、硫酸亞鐵、聚丙烯酰胺、聚合氯化鋁鐵、三氯化鐵、聚合硫酸鐵等)

(1)FeSO4·7H2O是常用的混凝劑,它在水中最終生成 沉淀。
(2)[A12(OH)nClm]是一種無機高分子的高價聚合電解質混凝劑,可視為介于三氯化鋁和氫氧化鋁之間的一種中間水解產物,則m與n之間的關系 ;
(3)推銷凈水器的商人用自來水做電解實驗,裝置如圖。一段時間后,兩極間產生白色沉淀,并很快變成紅褐色,然后用凈水器凈化后的水做電解實驗;兩極上只有氣體產生,水中并無沉淀,以此來說明自來水很“臟”。則沉淀變成紅褐色時所發生的化學反應方程式為: 。

(4)MnSO4是水質檢測中的一種常用試劑
①MnSO4和過硫酸鉀(K2S2O8)兩種鹽溶液在銀離子催化下可發生氧化還原反應,生成高錳酸鉀、硫酸鹽及另外一種產物,寫出并配平上述反應的化學方程式: 。
②水中的溶解氧測定過程為:取水樣,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振蕩使完全反應(反應為:Mn2++O2+H2O→MnOOH,未配平)。打開塞子,迅速加入適量硫酸溶液,此時有碘單質生成。則該離子反應方程式: 。用Na2S2O3溶液滴定生成的碘,根據消耗溶液的體積可計算出水中溶解氧的量。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com