
【題目】高氯酸鈉可用于制備高氯酸。以精制鹽水等為原料制備高氯酸鈉晶體(NaClO4·H2O)的流程如下:
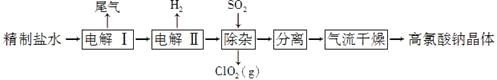
(1)由粗鹽(含Ca2+、Mg2+、SO42-、Br-等雜質)制備精制鹽水時需用到NaOH、BaCl2、Na2CO3等試劑。Na2CO3的作用是____________;除去鹽水中的Br-可以節省電解過程中的電能,其原因是________________。
(2)“電解Ⅰ”的目的是制備NaClO3溶液,產生的尾氣除H2外,還含有______________(填化學式)。“電解Ⅱ”的化學方程式為_____________________。
(3)“除雜”的目的是除去少量的NaClO3雜質,該反應的離子方程式為_______________________。“氣流干燥”時,溫度控制在80~100 ℃的原因是__________________。
【答案】除去Ca2+和引入的Ba2+ 電解時Br-被氧化 Cl2 NaClO3+H2O![]() NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 溫度太高,高氯酸鈉晶體失去結晶水或分解;溫度太低,干燥不充分
NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 溫度太高,高氯酸鈉晶體失去結晶水或分解;溫度太低,干燥不充分
【解析】
(1)粗鹽的提純中:Ca2+用CO32-除去、Mg2+用OH-除去、SO42-用Ba2+除去,除雜過程中過量除雜試劑必須除去,過量NaOH用鹽酸除去,過量的Ba2+用CO32-除去,過量CO32-用鹽酸除去,碳酸鈉的作用除去Ca2+和引入的Ba2+,根據電解池的放電順序,放電順序:Br->Cl-,除去Br-,在電解過程中直接電解Cl-,節省電能,因此原因:電解時Br-被氧化;
(2)根據題意,在陽極上Cl-放電生成ClO3-,也有可能放電生成Cl2,陰極上2H2O+2e-=H2↑+2OH-,尾氣中除含有氫氣外,可能含有氯氣,電解Ⅱ產生高氯酸鈉,陽極上電極反應式:ClO3-+H2O-2e-=ClO4-+2H+,陰極上電極反應式:2H++2e-=H2↑,兩式合并:ClO3-+H2O![]() ClO4-+H2↑,反應方程式:NaClO3+H2O
ClO4-+H2↑,反應方程式:NaClO3+H2O![]() NaClO4+H2↑;
NaClO4+H2↑;
(3)根據信息:SO2被氧化,ClO3-→ClO2,ClO3-+SO2→ClO2↑+SO42-,根據化合價升降法配平,其離子反應方程式為:2ClO3-+SO2=2ClO2+SO42-,實驗目的是制備NaClO4·H2O,溫度過高,高氯酸鈉晶體會失去結晶水,或溫度過高,高氯酸鈉分解,如果溫度過低,干燥不充分。


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:
【題目】濕垃圾又稱為廚余垃圾,廚余垃圾發酵液可通過電滲析法處理,同時得到乳酸的原理如圖所示(圖中HA表示乳酸分子,A-表示乳酸根離子)。 下列說法正確的是( ).
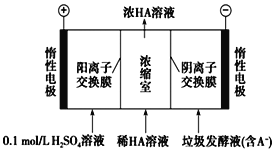
A.當有11.2LO2生成時,電路中通過2 mol e-的電量
B.電子從負極經電解質溶液回到正極
C.通電后,A-通過陰離子交換膜從陰極區進入濃縮室
D.通電后,陽極附近pH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在如圖所示電解質溶液的導電性裝置中,若向某一電解質溶液中逐滴加入另一種溶液時,則燈光由亮變暗至熄滅后又逐漸變亮的是( )
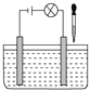
A.鹽酸中逐滴加入食鹽溶液
B.醋酸中逐滴加入氫氧化鈉溶液
C.飽和石灰水中不斷通入CO2
D.醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在36g炭不完全燃燒所得氣體中CO和CO2的體積比為1:2。已知:
C(s)+1/2O2(g) === CO(g); △H1=-110.35kJ/mol
CO(g)+1/2O2(g) === CO2(g);△H2=-282.57kJ/mol
則與36g炭完全燃燒相比,損失的熱量是( )
A.392.93kJB.282.57kJC.784.92kJD.3274.3kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用2a molL﹣1NaOH溶液滴定1.0L2a molL﹣1氫氟酸溶液,得到混合液中HF、F﹣的物質的量與溶液pH的變化關系如圖所示.下列說法正確的是( )
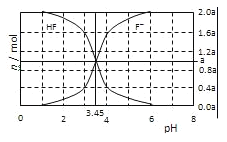
A.pH=3時,溶液中:c(Na+)<c(F﹣)
B.c(F﹣)>c(HF)時,溶液一定呈堿性
C.pH=3.45時,NaOH溶液恰好與HF完全反應
D.pH=4時,溶液中:c(HF)+c(Na+)+ c(H+)-c(OH﹣)<2amolL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知2molH2完全燃燒生成水蒸氣放出熱量484kJ,且1molH-H鍵斷裂時吸收熱量為436kJ,1molO=O鍵斷裂時吸收熱量為496kJ,則水蒸氣中1molH-O鍵形成時放出的熱量為_____。
(2)蓋斯定律認為:不管化學過程是一步完成或分幾步完成,整個過程的總熱效應相同。試運用蓋斯定律回答下列問題:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液態無水酒精完全燃燒,并恢復到室溫,則整個過程中放出的熱量為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對已達化學平衡的反應:2X(g)+Y(g)![]() 2Z(g),減小壓強后,對反應產生的影響是
2Z(g),減小壓強后,對反應產生的影響是
A.逆反應速率增大,正反應速率減小,平衡向逆反應方向移動
B.逆反應速率減小,正反應速率增大,平衡向正反應方向移動
C.正反應速率先減小后增大,逆反應速率減小,平衡向逆反應方向移動
D.逆反應速率先減小后增大,正反應速率減小,平衡向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將物質的量均為3mol的A、B混合于2L的密閉容器中,發生下列反應:3A(g)+B(g)![]() xC(g)+2D(g),經2min后測得D的濃度為0.5mol/L,以C表示的平均速率v(C)=0.25molL-1min-1,下列說法正確的是( )
xC(g)+2D(g),經2min后測得D的濃度為0.5mol/L,以C表示的平均速率v(C)=0.25molL-1min-1,下列說法正確的是( )
A.反應速率v(B)=0.25molL-1min-1
B.該反應方程式中,x=1
C.2min時,A的物質的量為1.5mol
D.2min時,A的轉化率為60%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鈦廣泛用于耐高溫、耐磨損及航空航天等領域。一種氮化鈦的制備反應為:6TiCl4+8NH3=6TiN+24HCl+N2,回答下列問題:
(1)鈦在元素周期表中的位置為_____________,基態Ti原子價層電子的軌道表達式為________。
(2)氮可與其他元素形成正離子,如NH4Cl中的NH4+,N2O5中的NO2+。組成這兩種正離子的元素中第一電離能由小到大的順序為____________;NH4+的空間構型為___________;NO2+中氮原子的雜化形式為_______,其中σ鍵與π鍵的數目比為_________。
(3)四氯化鈦晶體的熔點為-23℃,沸點為136℃,則TiCl4晶體的類型為___________,該晶體中微粒之間的作用力為___________。
(4)一種TiN金黃色晶體晶胞結構與NaCl相同(如圖),該晶胞中N原子數目為_______;該氮化鈦的密度為5.4g/cm3,則其晶胞參數a=___________pm(用NA表示阿伏加德常數的數值,只列算式)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com