
【題目】設計方案是實驗探究的保證,感悟方法是探究的根本目的。某合作學習小組開展了如下探究:
實驗一:檢驗氫氧化鈉溶液中是否含有氫氧化鈣。
(分析)從組成上看,氫氧化鈣和氫氧化鈉都屬于堿,它們在水溶液中都能解離出相同的_______(填符號),所以具有相似的化學性質。但由于解離出的Na+和Ca2+不同,所以性質也有不同。設計實驗時可加入能解離出CO32﹣的試劑利用CO32﹣與Ca2+結合產生白色沉淀這一特殊現象予以檢驗。
(設計方案并實驗)
實驗操作 | 現象 | 結論 | |
方案一 | 取少量待測溶液于試管中,通入CO2 | 出現白色沉淀 | 氫氧化鈉溶液中含有氫氧化鈣 |
方案二 | 取少量待測溶液于試管中,滴加 _________溶液 | 出現白色沉淀 |
寫出上述方案中出現白色沉淀的一個化學方程式__________________________________________。
(方法感悟)在檢驗物質時,要分析物質的組成和______。據此選擇加入恰當的試劑,最后根據不同現象得出結論。
(實驗探究)實驗二:有一包白色固體,可能含有氯化鈉、氫氧化鈉、碳酸鈉、硫酸鈉和硝酸鋇中的一種或幾種,為探究其組成,某合作學習小組設計方案并進行了如下實驗:

(1)上述實驗中,過濾操作用到的玻璃儀器有:燒杯、玻璃棒和_________。
(2)小晶同學通過上述實驗推知:白色固體樣品中一定不含有_________。(填化學式)
(3)為確定白色固體樣品中可能存在的物質,小燕對沉淀C進行實驗。
實驗操作 | 現象 | 結論 |
取少量沉淀C于試管中,加入過量 _________。 | 有氣泡產生,沉淀全部消失。 | 白色固體樣品中一定含有 ________。 |
(4)小虎同學認為白色固體中還要物質不能確認其是否存在.其理由是:_________________。
(用化學方程式表示)如要確認,只需將上述實驗方案中所加的一種試劑改為_______即可。
(方法感悟)若其他物質的存在對所檢驗的物質有干擾時,可先將干擾物質轉化,再選擇加入恰當的試劑,最后根據不同現象得出結論。
【答案】OH- K2CO3 (或Na2CO3 或(NH4)2CO3)Ca(OH)2 +CO2═CaCO3 ↓+H2O( 或Ca(OH)2 +Na2CO3═CaCO3 ↓+2NaOH )性質(或化學性質)漏斗Ba(NO3)2稀鹽酸(或稀硝酸)Na2CO3BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2 (或BaCl2+Na2CO3= BaCO3↓+2NaCl)Ba(NO3)2溶液
【解析】
從組成上看,氫氧化鈣和氫氧化鈉都屬于堿,它們在水溶液中都能解離出相同的OH-。溶液中含有氫氧化鈣,能和二氧化碳或碳酸鹽反應生成沉淀,所以所加入的試劑為可溶性的碳酸鹽,可能是K2CO3 (或Na2CO3 或(NH4)2CO3)。氫氧化鈣和二氧化碳反應生成碳酸鈣沉淀和水,方程式為:Ca(OH)2 +CO2═CaCO3 ↓+H2O,氫氧化鈣和碳酸鈉反應生成碳酸鈣和氫氧化鈉,方程式為Ca(OH)2 +Na2CO3═CaCO3 ↓+2NaOH 。通過實驗可以分析物質的組成和化學性質。(1)過濾實驗中使用到的儀器有漏斗; (2) 加入過量的氯化鋇溶液時,產生白色沉淀C,說明白色固體中含有碳酸鈉或硫酸鈉或碳酸鈉和硫酸鈉,當白色固體中含有碳酸鈉或硫酸鈉時,一定不含硝酸鋇,這是因為硝酸鋇能和碳酸鈉或硫酸鈉反應生成白色沉淀。(3)取少量沉淀C于試管中,加入過量的稀鹽酸(或稀硝酸),沉淀全部消失,說明白色沉淀是碳酸鋇,因此白色固體中一定含有Na2CO3,加入過量的氯化鋇溶液和酚酞試液時得到紅色溶液,說明白色固體中含有氫氧化鈉。(4)加入稀硝酸和硝酸銀時產生白色沉淀,不能說明白色固體中含有氯化鈉,這是因為加入氯化鋇溶液時帶入了氯離子,反應方程式為:BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2(或BaCl2+Na2CO3= BaCO3↓+2NaCl),如要確認是否含有氯化鈉,只需要將上述實驗方案中所加的過量的氯化鋇溶液改為硝酸鋇溶液即可。


科目:高中化學 來源: 題型:
【題目】科學家積極探索新技術對CO2進行綜合利用。請回答下列問題:
(1)已知: H2的燃燒熱為285.8kJ/mol,C2H4的燃燒熱為1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,則CO2 和H2反應生成乙烯和水蒸氣的熱化學方程式為____________,上述反應在__________下自發進行(填“高溫”或“低溫”)。
(2)乙烯是一種重要的氣體燃料,可與氧氣、熔融碳酸鈉組成燃料電池。寫出該燃料電池負極的電極反應式:_______________________.
(3)在體積為1L的密閉容器中,充入3mol H2和1mol CO2,測得溫度對CO2的平衡轉化率和催化劑催化效率的影響如圖所示。
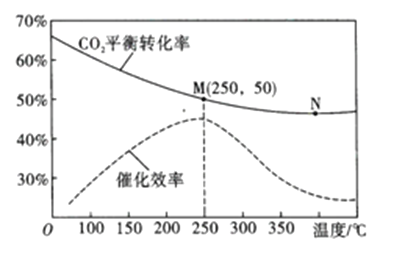
①平衡常數: KM__________KN (填“>”“<”或“=”)。
②下列說法正確的是_________(填序號)。
A.當混合氣體密度不變時,說明反應達到平衡狀態
B.當壓強或n(H2)/n(CO2)不變時,均可證明反應已達平衡狀態
C.當溫度高于250℃時,因為催化劑的催化效率降低,所以平衡向逆反應方向移動
D.若將容器由“恒容”換為“恒壓”,其他條件不變,則CO2的平衡轉化率增大
③250℃時,將平衡后的混合氣體(不考慮平衡移動) 通入300mL 3mol/L的NaOH溶液中充分反應,則所得溶液中所有離子的濃度大小關系為__________
④圖中M點對應乙烯的質量分數為_____________。
(5)達平衡后,將容器體積瞬間擴大至2L并保持不變,平衡向_____移動(填“正向”“逆向”或“不”),容器內混合氣體的平均相對分子質量______(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以NA代表阿伏加德羅常數,則關于熱化學方程式 C2H2 (g) +5/2O2 (g) →2CO2 (g)+H2O(l) △H = —1300kJ / mol 的說法中,正確的是 ( )
A. 當8 NA個電子轉移時,該反應放出1300kJ的能量
B. 當1 NA個水分子生成且為液體時,吸收1300kJ的能量
C. 當2 NA個碳氧共用電子對生成時,放出1300kJ的能量
D. 當8 NA個碳氧共用電子對生成時,放出1300kJ的能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在無色透明酸性溶液中,能共存的離子組是( )
A.NH4+、OH﹣、Al3+、Cl﹣
B.K+、SO42﹣、HCO3﹣、Na+
C.Mg2+、NO3﹣、Cl﹣、Na+
D.MnO4﹣、K+、SO42﹣、Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅在我國有色金屬材料的消費中僅次于鋁,廣泛地應用于電氣、機械制造、國防等領域。回答下列問題:
(1)用晶體的X射線衍射法可以測得阿伏加德羅常數。對金屬銅的測定得到以下結果:晶胞為面心立方最密堆積,邊長為361 pm。又知銅的密度為9.00 g·cm-3,阿伏加德羅常數為__________ (列式計算,已知Ar(Cu)=63.6);
(2)氯和鉀與不同價態的銅可生成兩種化合物,這兩種化合物都可用于催化乙炔聚合,其陰離子均為無限長鏈結構(如下圖),a位置上Cl原子的雜化軌道類型為______。已知其中一種化合物的化學式為KCuCl3,另一種的化學式為_______;

(3)金屬銅單獨與氨水或單獨與過氧化氫都不能反應,但可與氨水和過氧化氫的混合溶液反應,其原因是___________,反應的化學方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組通過如右圖所示裝置探究MnO2與FeCl3·6H2O能否反應產生Cl2。

實驗操作和現象:
操作 | 現象 |
點燃酒精燈,加熱 | i.A中部分固體溶解,上方出現白霧 ii.稍后,產生黃色氣體,管壁附著黃色液滴 iii.B中溶液變藍 |
(1)實驗前要首先進行的操作是____________.
(2)現象Ⅰ中白霧的成分是_________(填名稱),形成白霧的原因是________.
(3)將現象Ⅰ中得到的黃色氣體通入KSCN溶液,溶液變紅。則現象Ⅱ中黃色氣體除了Cl2還含有________ (填化學式);該物質能使B中KI-淀粉溶液變藍,發生反應的離子方程式是______.
(4)為了確認現象Ⅱ中黃色氣體中含有Cl2,小組提出如下方案:
方案:將B中KI-淀粉溶液替換為NaBr溶液。
現象:B中溶液呈淺橙紅色;未檢出Fe2+。
a.寫出用鐵氰化鉀溶液檢驗Fe2+原理的離子方程式:_________
b.方案中檢驗Fe2+的原因是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表是A、B、C、D、E五種有機物的有關信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型為 ③能與水在一定條件下反應生成C |
B | ①由C、H兩種元素組成 ②球棍模型為 |
C | ①由C、H、O三種元素組成 ②能與Na反應 ③與E反應生成相對分子質量為88的酯 |
D | ①相對分子質量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三種元素組成 ②其水溶液能使紫色石蕊溶液變紅 ③可由C發生氧化反應得到 |
回答下列問題:
(1)A~E中,屬于烴的是________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,發生反應的化學方程式為_______。
(3)C催化氧化生成D的化學方程式為_____________________。
(4)有機物B具有的性質是________(填序號)。
①無色無味的溶液;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)寫出B與溴在催化劑作用下發生反應的化學方程式為_______。
(6)寫出E與C反應生成相對分子質量為88的酯的化學方程式為______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com