
【題目】已知在25℃時,醋酸、次氯酸、碳酸和亞硫酸的電離平衡常數分別為:
醋酸K=1.75×10-5
次氯酸K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11
亞硫酸K1=1.54×10-2 K2=1.02×10-7
(1)寫出碳酸的第一級電離平衡常數表達式:K1=________。
(2)若保持溫度不變,在醋酸溶液中通入少量HCl,下列量會變小的是________(填字母,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的電離平衡常數
(3)下列離子方程式中錯誤的是________。
a.少量CO2通入次氯酸鈉溶液中:CO2+H2O+ClO-===![]() +HClO
+HClO
b.少量SO2通入次氯酸鈣溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.過量CO2通入澄清石灰水中:CO2+OH-===![]()
【答案】![]() a b
a b
【解析】
(1)根據電離平衡常數的含義可得碳酸的第一級電離平衡常數表達式K1=c(H+)c(HCO3-)/c(H2CO3);
(2)若保持溫度不變,在醋酸溶液中通入少量HCl,a.CH3COO-會結合H+形成CH3COOH,所以c(CH3COO-)變小,故a項正確;
b.由于加入了H+,所以c(H+)會增大,故b項錯誤;
c.醋酸的電離平衡常數只與溫度有關,溫度不變,所以電離平衡常數不變,故c項錯誤;
綜上,本題選a;
(3)a.由于酸性H2CO3>HClO> HCO3-,所以少量CO2通入次氯酸鈉溶液中,會發生反應:CO2+H2O+ClO-= HCO3-+HClO,故a項正確;
b.由于HClO有強氧化性,而H2SO3有還原性,所以少量SO2通入次氯酸鈣溶液中,會發生氧化還原反應:Ca2++ClO-+SO2+H2O=CaSO4↓+2H++Cl-,故b項錯誤;
c.過量CO2通入澄清石灰水中,發生反應得到可溶性酸式鹽,離子方程式是:CO2+OH-= HCO3-,故c項正確。
綜上,本題選b。


科目:高中化學 來源: 題型:
【題目】如圖所示,某化學小組擬用該裝置制取純凈的O2。

(1)若C是一種淡黃色固體,則燒瓶中發生反應的化學方程式是___。
(2)若C是一種黑色粉末,則B是_________,C的作用是________________。
(3)廣口瓶中盛裝的試劑D是___________,其作用是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿佛加德羅常數為NA,下列敘述正確的是
A.1molD2O所含質子數為12NA;B.1molNa2O2與足量水反應轉移電子數為2NA;
C.10g 氖氣所含原子數為0.5NA;D.標況下22.4L正戊烷含氫原子數為12NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W在元素周期表中的相對位置如下圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法不正確的是( )

A. 原子半徑:W>Z>Y>X
B. 最高價氧化物對應水化物的酸性:X>W>Z
C. 最簡單氣態氫化物的熱穩定性:Y>X>W>Z
D. 元素X、Z、W的最高化合價分別與其主族序數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量氨基甲酸銨加入恒容容器中:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。該反應的平衡常數的負對數(-lgK)值隨溫度(T)的變化曲線如圖所示,下列說法錯誤的是
2NH3(g)+CO2(g)。該反應的平衡常數的負對數(-lgK)值隨溫度(T)的變化曲線如圖所示,下列說法錯誤的是
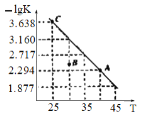
A. 該反應的生成物總能量大于反應物總能量
B. 處于A點的CO2的消耗速率大于處于C點的CO2消耗速率
C. B點時,v逆>v正
D. CO2的體積分數不變時反應一定達到平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學降解![]() 的原理如圖所示。下列說法不正確的是
的原理如圖所示。下列說法不正確的是

A. 鉛蓄電池的負極反應為:Pb - 2e-+ SO42- =PbSO4
B. 電解一段時間后,若不考慮溶液體積變化,交換膜左側溶液酸性增強,右側溶液酸性減弱
C. 該電解池的陰極反應式為2NO3-+12H++10e-=N2↑+6H2O
D. 若電解過程中轉移2mole-,則質子交換膜左側電解液的質量減少Δm(左) =18.0g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組以亞硝酸鈉(NaNO2)溶液為研究對象,探究NO2-的性質。
實驗 | 試劑 | 編號及現象 | |
滴管 | 試管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 實驗I:溶液變為淺紅色,微熱后紅色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 實驗II:開始無明顯變化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 實驗III:無明顯變化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 實驗IV:溶液先變黃,后迅速變為棕色,滴加KSCN溶液變紅 | |
資料:[Fe(NO)]2+在溶液中呈棕色。
(1)結合化學用語解釋實驗I“微熱后紅色加深”的原因 ______
(2)實驗II證明NO2-具有_____性, 從原子結構角度分析原因_________
(3)探究實驗IV中的棕色溶液
①為確定棕色物質是NO與Fe2+,而非Fe3+發生絡合反應的產物,設計如下實驗,請補齊實驗方案。
實驗 | 溶液a | 編號及現象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速變為___色 |
____________________ | ii.無明顯變化 |
②加熱實驗IV中的棕色溶液,有氣體逸出,該氣體在接近試管口處變為紅棕色,溶液中有紅褐色沉淀生成。解釋上述現象產生的原因_________。
(4)絡合反應導致反應物濃度下降,干擾實驗IV中氧化還原反應發生及產物檢驗。小組同學設計實驗V:將K閉合后電流表指針發生偏轉,向左側滴加醋酸后偏轉幅度增大。
①鹽橋的作用是____________________________
②電池總反應式為______________________
實驗結論:NO2-在一定條件下體現氧化性或還原性,氧還性強弱與溶液酸堿性等因素有關。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2NO2![]() 2N0+O2在密閉容器中反應,達到平衡狀態的標志是( )
2N0+O2在密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成nmolO2的同時生成2nmolNO2
②單位時間內生成nmolO2的同時生成2nmolNO
③用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2 : 2 : l 的狀態
④混合氣體的顏色不再改變的狀態
A. ①④ B. ②③ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀鹽酸,CO2的生成量與加入鹽酸的體積(V)的關系如圖所示。下列判斷正確的是( )

A.在0~a范圍內,只發生中和反應
B.a=0.3
C.ab段發生反應的離子方程式為CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH與Na2CO3的物質的量之比為1∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com