
(2010?江蘇)下列實驗操作與預期實驗目的或所得實驗結論一致的是( )
|


 唐印文化課時測評系列答案
唐印文化課時測評系列答案 導學與測試系列答案
導學與測試系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2010?江蘇)高純MnCO3是制備高性能磁性材料的主要原料.實驗室以MnO2為原料制備少量高純MnCO3的操作步驟如下:
(2010?江蘇)高純MnCO3是制備高性能磁性材料的主要原料.實驗室以MnO2為原料制備少量高純MnCO3的操作步驟如下:
查看答案和解析>>
科目:高中化學 來源: 題型:

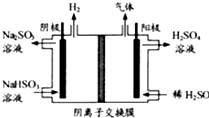
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com