
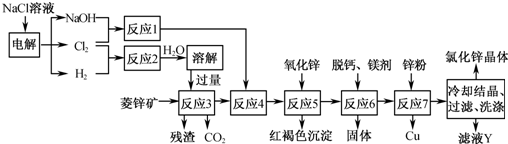
用菱鋅礦(主要成分為碳酸鋅,還含有Fe2+ 、Fe3+、 Mg2+、 Ca2+ 、Cu2+等)制備氯化鋅的一種流程如下:

(1)在反應3前要將菱鋅礦研磨,其目的是_______________________________
(2)反應4將Fe2+氧化為Fe3+,該反應的離子方程式為______________________
(3)加入氧化鋅調節pH=4.5,反應5的離子方程式為________________________
(4)鋅粉不在反應4之前加的原因是____________________________________
(5)若用石墨作電極電解濾液Y,則可以得到參與本流程反應的物質有_________
(15分)
(1)增大反應物接觸面積,加快反應3的反應速率
(2)2Fe2+ + ClO- + 2H+ = 2 Fe3+ + Cl- + H2O
(3)ZnO + 2H+ = Zn2+ + H2O 、Fe3+ + 3H2O  Fe(OH)3+
3 H+
Fe(OH)3+
3 H+
或3 ZnO + 2 Fe3+ + 3H2O = Fe(OH)3↓ + 3 Zn2+
(4)Zn和H+以及Fe3+反應,將增加Zn的用量以及后續實驗中次氯酸鈉(或氯酸鈉)的用量
(5)H2 、Cl2、Zn
【解析】
試題分析:
(1)依據影響化學反應速率的因素分析判斷,增大接觸面積會增大反應速率,故答案為:增大反應物接觸面積,使反應3反應速率加快;
(2)反應1是氯氣與氫氧化鈉溶液反應,產物是NaClO、NaClO3和水,反應3中加入了過量鹽酸,反應4中將Fe2+氧化為Fe3+,反應的離子方程式為:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,
(3)加入氧化鋅調節溶液的pH=4.5,同時得到紅褐色沉淀Fe(OH)3,同時不引入新的雜質;反應的離子方程式為:ZnO+2H+═Zn2++H2O,Fe3++3H2O⇌Fe(OH)3↓+3H+,
(4)因為菱鋅礦中含有雜質離子Fe3+,以及加入的鹽酸均可以與鋅粉反應,這樣鋅的用量增加,并造成后續反應中所用的次氯酸鈉或氯酸鈉的用量也增加,
(5)濾液Y是ZnCl2,用石墨作電極,電解時首先得到H2和Cl2,當ZnCl2濃度較大時還可以得到Zn,故答案為:H2、Cl2、Zn。
考點定位:本題考查了物質制備流程的分析判斷,影響化學反應速率的因素,難溶電解質的溶解平衡及沉淀轉化的本質,常見金屬元素的單質及其化合物的綜合應用。離子方程式書寫,電解原理的應用,題目難度中等。


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:南京一模 題型:問答題

查看答案和解析>>
科目:高中化學 來源:江蘇模擬題 題型:填空題

(1)在反應3前要將菱鋅礦研磨,其目的是__________________。
(2)反應4將Fe2+氧化為Fe3+,該反應的離子方程式為______________________。
(3)加入氧化鋅調節pH=4.5,反應5的離子方程式為______________________。
(4)鋅粉不在反應4之前加入的原因是___________________。
(5)若用石墨作電極電解濾液Y,則可以得到參與本流程反應的物質有____________。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省揚州市邗江區蔣王中學高三(上)期中化學模擬試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com