
【題目】X、Y、Z、W代表短周期的四種元素,有關它們的部分信息如表所示:
元素 | 部分結構特點 | 部分性質 |
X | X的單質由雙原子分子構成,分子中有14 | X有多種氧化物,如XO、XO2等 |
Y | Y原子的次外層電子數等于最外層電子數 | Y元素能形成多種單質 |
Z | Z原子的最外層電子數多于4 | Z元素的最高正化合價與最低負化合價的代數和等于6 |
W | 第三周期元素的簡單離子中半徑最小 | W的單質化學性質雖較活潑,但只需常溫保存 |
請按要求回答下列問題(注意不能用字母X、Y、Z、W作答,請用相應的元素符號或化學式填寫):
(1)X的元素名稱是,X的氣態氫化物的電子式是 .
(2)Z元素在周期表中的位置是第周期,第族.Z和W形成的化合物屬于化合物(填“離子”或“共價”).
(3)X、Y、Z、W的原子半徑從大到小的順序是 .
(4)X、Y、Z三種元素的最高價氧化物的水化物的酸性由強到弱的順序是: .
(5)銅和X的最高價氧化物的水化物的濃溶液反應的化學方程式: .
(6)氣體分子(YX)2稱為擬鹵素,性質與鹵素類似,請寫出(YX)2與NaOH溶液反應的化學方程式: .
【答案】
(1)![]()
(2)共價
(3)Al>Cl>C>N
(4)HClO4>HNO3>H2CO3
(5)Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O
(6)(CN)2+2NaOH=NaCN+NaCNO+H2O
【解析】解:(1)X的元素名稱是氮,N原子的最外層有5個電子,其中3個未成對電子和1對成對電子,3個未成對電子分別和3個H原子形成3對共用電子對,故氨氣的電子式為 ![]() ,所以答案是:氮;
,所以答案是:氮; ![]() ;(2)氯元素在周期表中的位置是第三周期,第ⅦA族,Cl和Al形成的化合物屬于共價化合物,所以答案是:三;ⅦA;共價;(3)電子層數越多半徑越大,電子層數相同時核電荷數越多半徑越小,所以原子半徑從大到小的順序是Al>Cl>C>N,所以答案是:Al>Cl>C>N;(4)非金屬性越強,最高價氧化物對應水化物的酸性越強,X、Y、Z三種元素的最高價氧化物的水化物的酸性由強到弱的順序是HClO4>HNO3>H2CO3 , 所以答案是:HClO4>HNO3>H2CO3;(5)銅和濃硝酸反應的化學方程式為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,所以答案是:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O;(6)氣體分子(CN)2稱為擬鹵素,性質與鹵素類似,與氫氧化鈉發生自身的氧化還原反應,反應方程式為:(CN)2+2NaOH=NaCN+NaCNO+H2O,所以答案是:(CN)2+2NaOH=NaCN+NaCNO+H2O.
;(2)氯元素在周期表中的位置是第三周期,第ⅦA族,Cl和Al形成的化合物屬于共價化合物,所以答案是:三;ⅦA;共價;(3)電子層數越多半徑越大,電子層數相同時核電荷數越多半徑越小,所以原子半徑從大到小的順序是Al>Cl>C>N,所以答案是:Al>Cl>C>N;(4)非金屬性越強,最高價氧化物對應水化物的酸性越強,X、Y、Z三種元素的最高價氧化物的水化物的酸性由強到弱的順序是HClO4>HNO3>H2CO3 , 所以答案是:HClO4>HNO3>H2CO3;(5)銅和濃硝酸反應的化學方程式為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,所以答案是:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O;(6)氣體分子(CN)2稱為擬鹵素,性質與鹵素類似,與氫氧化鈉發生自身的氧化還原反應,反應方程式為:(CN)2+2NaOH=NaCN+NaCNO+H2O,所以答案是:(CN)2+2NaOH=NaCN+NaCNO+H2O.


科目:高中化學 來源: 題型:
【題目】2017天津]常壓下羰基化法精煉鎳的原理為:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃時,該反應的平衡常數K=2×105。已知:Ni(CO)4的沸點為42.2℃,固體雜質不參與反應。
Ni(CO)4(g)。230℃時,該反應的平衡常數K=2×105。已知:Ni(CO)4的沸點為42.2℃,固體雜質不參與反應。
第一階段:將粗鎳與CO反應轉化成氣態Ni(CO)4;
第二階段:將第一階段反應后的氣體分離出來,加熱至230℃制得高純鎳。
下列判斷正確的是
A.增加c(CO),平衡向正向移動,反應的平衡常數增大
B.第一階段,在30℃和50℃兩者之間選擇反應溫度,選50℃
C.第二階段,Ni(CO)4分解率較低
D.該反應達到平衡時,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NOx、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)處理含CO、SO2煙道氣污染的一種方法是將其在催化劑作用下轉化為單質S。已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=283.0 kJ·mol1
O2(g)===CO2(g) ΔH=283.0 kJ·mol1
②S(s)+O2(g)===SO2(g) ΔH=296.0 kJ·mol1
此反應的熱化學方程式是___________________________________。
(2)氮氧化物是造成光化學煙霧和臭氧層損耗的主要氣體。已知:
CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=a kJ·mol1(a>0)
2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=b kJ·mol1(b>0)
若用標準狀況下3.36 L CO還原NO2至N2(CO完全反應)的整個過程中轉移電子的物質的量為________mol,放出的熱量為______________kJ(用含有a和b的代數式表示)。
(3)用CH4催化還原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1①
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4還原NO2至N2,整個過程中放出的熱量為867 kJ,則ΔH2=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色稀溶液X中,可能含有如表所列離子中的某幾種。
陰離子 | CO |
陽離子 | Al3+、Fe3+、Mg2+、NH |
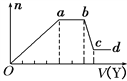
取該溶液適量,向其中加入某試劑Y,產生沉淀的物質的量(n)與加入試劑體積(V)的關系如圖所示。
(1)若Y是鹽酸,則溶液中含有的陽離子是______ ,ab段發生反應的總離子方程式為____________, Oa段上表中參加反應的離子的物質的量之比為________________________。
[要標明離子符號,如n(Fe3+)].
(2)若Y是NaOH溶液,則X中一定含有上表中的離子是________________________,它們的離子個數比為______________________________,[按陽離子在前,陰離子在后,高價在前,低價在后的順序排列].ab段反應的離子方程式為______________________________, bc段反應的離子方程式為____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于水的生理功能的敘述中,不正確的是
A. 自由水是良好的溶劑
B. 水溶液可運輸代謝廢物到排泄器官
C. 結合水是細胞結構的重要組成成分
D. 水參與代謝時能提供能量供生命活動需要
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】僅用下表提供的玻璃儀器(非玻璃儀器任選)或實驗裝置就能實現相應實驗目的是( )
選項 | 實驗目的 | 實驗儀器或裝置 |
A | 除去KCl中少的 MnO2 | 燒杯、玻璃棒、分液漏斗 |
B | 用10mol/L的鹽酸配制100mL0.1mol/L的鹽酸 | 100mL容量瓶、玻璃棒、燒杯 |
C | 用氯化鈉溶液制備氯化鈉晶體 |
|
D | 用右圖裝置驗證SO2的漂白性 |
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是不同溫度下水的離子積數據:
溫度/℃ | 25 | t1 | t2 |
水的離子積常數 | 1×10-14 | α | 1×10-12 |
試回答以下問題:
(1)若25<t1<t2,則α____(填“<”“>”或“=”)1×10-14,作出此判斷的理由是___________________。
(2)25 ℃下,某Na2SO4溶液中c(![]() )=5×10-4mol·L-1,取該溶液1 mL,加水稀釋至10 mL,則稀釋后溶液中c(Na+)∶c(OH-)=________。
)=5×10-4mol·L-1,取該溶液1 mL,加水稀釋至10 mL,則稀釋后溶液中c(Na+)∶c(OH-)=________。
(3)t2 ℃下,將pH=11的苛性鈉溶液V1 L與pH=1的稀硫酸V2 L混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2,則V1∶V2=________。此溶液中各種離子的濃度由大到小的排列順序是_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作電極電解此溶液,當通電一段時間后,兩極均收集到22.4L氣體(標準狀況),若液體體積變化忽略不計,下列說法正確的是
A. 原混合溶液中n(K+)為2 mol B. 上述電解過程中共轉移4 mol電子
C. 電解得到的Cu的物質的量為0.5 mol D. 電解后溶液中c(H+)為2 mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com