
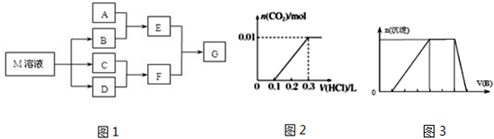
分析 (1)C可在D中燃燒發出蒼白色火焰,為氫氣與氯氣反應生成HCl,可推知C為H2、D為Cl2、F為HCl,M是日常生活中不可缺少的調味品,M的溶液電解生成氫氣、氯氣與B,可推知M為NaCl、B為NaOH,
(2)若A是一種常見的酸性氧化物,且可用于制造玻璃,則A為SiO2,E為Na2SiO3,E與F溶液反應可以制備G為H2SiO3;
(3)曲線中,從0.1L~0.3L發生反應NaHCO3+HCl=NaCl+CO2↑+H2O,該階段消耗鹽酸為200mL,而開始產生二氧化碳時消耗鹽酸為100mL,小于200mL,所以溶液中的溶質成分NaHCO3、Na2CO3;
(4)若A是一種常見金屬單質,且與NaOH溶液能夠反應,則A為Al,E為NaAlO2,則將過量的HCl溶液加入NaAlO2溶液中反應生成鋁鹽;
(5)若A是一種化肥,實驗室可用A和NaOH反應制取氣體E,則E為NH3、A為銨鹽,E與氯氣相遇均冒白煙,則氨氣與氯氣反應生成氯化銨,同時生成氮氣;
(6)由圖可知,開始加入NaOH沒有沉淀和氣體產生,則一定有H+,一定沒有CO32-,后來有沉淀產生且最后消失,則一定沒有Mg2+、Fe3+,一定含有Al3+;中間段沉淀的質量不變,應為NH4++OH-=NH3•H2O的反應,則含有NH4+,由電荷守恒可知一定含有SO42-,根據各階段消耗的NaOH體積結合離子方程式計算n(H+):n(Al3+):n(NH4+)之比,再結合電荷守恒計算與n(SO42-)的比例關系,據此計算.
解答 解:(1)C可在D中燃燒發出蒼白色火焰,為氫氣與氯氣反應生成HCl,可推知C為H2、D為Cl2、F為HCl,M是日常生活中不可缺少的調味品,M的溶液電解生成氫氣、氯氣與B,可推知M為NaCl、B為NaOH,B中含有離子鍵、共價鍵,
故答案為:離子鍵、共價鍵;
(2)若A是一種常見的酸性氧化物,且可用于制造玻璃,則A為SiO2,E為Na2SiO3,與F溶液反應可以制備G為H2SiO3,E溶液的俗稱是水玻璃,
故答案為:水玻璃;
(3)假設溶質為碳酸鈉,則前后消耗鹽酸的體積應相等,而曲線中,從0.1L~0.3L發生反應NaHCO3+HCl=NaCl+CO2↑+H2O,該階段消耗鹽酸為200mL,而開始產生二氧化碳時消耗鹽酸為100mL,小于200mL,所以溶液中的溶質成分NaHCO3、Na2CO3,
故答案為:NaHCO3、Na2CO3;
(4)若A是一種常見金屬單質,且與NaOH溶液能夠反應,則A為Al,E為NaAlO2,則將過量的HCl溶液加入NaAlO2溶液中,所發生反應的離子方程式是:AlO2-+4H+=Al3++2H2O,
故答案為:AlO2-+4H+=Al3++2H2O;
(5)若A是一種化肥,實驗室可用A和NaOH反應制取氣體E,則E為NH3、A為銨鹽,E與氯氣相遇均冒白煙,則氨氣與氯氣反應生成氯化銨,同時生成氮氣,A溶液中陽離子的檢驗方法:取A溶液少量于試管中,加入適量NaOH溶液,加熱,若產生的氣體能使濕潤的紅色石蕊試紙變成藍色,說明A溶液中的陽離子是NH4+,
故答案為:取A溶液少量于試管中,加入適量NaOH溶液,加熱,若產生的氣體能使濕潤的紅色石蕊試紙變成藍色,說明A溶液中的陽離子是NH4+;
(6)由圖可知,開始加入NaOH沒有沉淀和氣體產生,則一定有H+,一定沒有CO32-,后來有沉淀產生且最后消失,則一定沒有Mg2+、Fe3+,一定含有Al3+;中間段沉淀的質量不變,應為NH4++OH-=NH3•H2O的反應,則含有NH4+,由電荷守恒可知一定含有SO42-,發生反應H++OH-=H2O,氫離子消耗NaOH溶液的體積為1體積,發生反應Al3++3OH-=Al(OH)3↓,鋁離子消耗NaOH溶液的體積為3體積,發生反應NH4++OH-=NH3•H2O,銨根消耗氫氧化鈉為2體積,則n(H+):n(Al3+):n(NH4+)=1:1:2,由電荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案為:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.
點評 本題考查無機物推斷等,題目涉及元素化合物較多,需要學生全面掌握據基礎知識,(6)中根據圖象中的平臺確定含有銨根離子是關鍵,注意離子方程式與電荷守恒的應用,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 混合氣體一定是CH4和C2H4 | |
| B. | 混合氣體中一定有CH4,可能含有C2H4 | |
| C. | 混合氣體中一定含有CH4,可能含有C2H6 | |
| D. | 混合氣體中可能含有C2H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 .
. .
.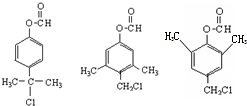 .
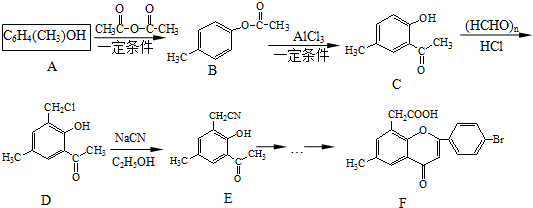
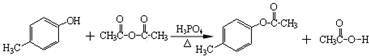
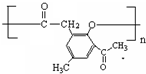
.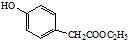 )是一種重要的醫藥中間體.完成以A和乙醇為主要原料制備對羥基苯乙酸乙酯的合成路線流程圖(無機試劑任選).
)是一種重要的醫藥中間體.完成以A和乙醇為主要原料制備對羥基苯乙酸乙酯的合成路線流程圖(無機試劑任選).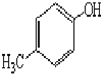 $→_{一定條件}^{Cl_{2}}$
$→_{一定條件}^{Cl_{2}}$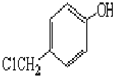
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入NaHSO4固體,ν(H2)不變 | B. | 加入少量水,ν(H2)減小 | ||
| C. | 加入CH3COONa固體,ν(H2)不變 | D. | 滴加少量CuSO4溶液,ν(H2)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L 0.1mol•L-1FeCl3溶液中含有的Fe3+離子數目為0.1NA | |
| B. | 室溫下,1L pH=13的NaOH溶液中,由水電離的OH-離子數目為0.1NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反應中,生成28g N2時,轉移的電子數目為3.75NA | |
| D. | 常溫下,2.24LCl2完全與NaOH溶液反應,轉移的電子數目一定為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:2 | B. | 3:5 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol H2SO4的質量為98g•mol-1 | |
| B. | H2SO4的摩爾質量為98g | |
| C. | 6.02×1022個H2SO4分子的質量為9.8g | |
| D. | 9.8 g H2SO4含有6.02×1023個H2SO4分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 60mL | B. | 45mL | C. | 30mL | D. | 無法計算 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com