
【題目】科學家發現對冶金硅進行電解精煉提純可降低高純硅制備成本。相關電解槽裝置如圖所示,用CuSi合金作硅源,在950℃利用三層液熔鹽進行電解精煉,下列說法正確的是( )
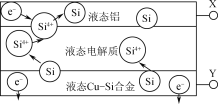
A.X與電源的正極相連
B.電子能夠在三層液熔鹽間自由流動
C.電子由液態CuSi合金流出
D.在該液相熔體中Cu優先于Si被氧化,Si4+優先于Cu2+被還原
【答案】C
【解析】
由圖可知該裝置為電解池:Si4+在液態鋁電極得電子轉化為Si,所以液態鋁電極為陰極,X連接電源負極,則Cu-Si合金所在電極為陽極,Y與電源正極相接,三層液熔鹽在電解槽中充當電解質,可以供離子自由移動,并增大電解反應面積,提高硅沉積效率。
A.Si4+在液態鋁電極得電子轉化為Si,所以液態鋁電極為陰極,X連接電源負極,故A錯誤;
B.電子只能在外電路中移動,不能夠在三層液熔鹽間自由流動,故B錯誤;
C.由圖可知:液態鋁為陰極,連接電源負極,所以電子流入液態鋁,液態Cu-Si合金為陽極,電子由液態Cu-Si合金流出,故C正確;
D.由圖可知,電解池的陽極上Si失電子轉化為Si4+,陰極反應為Si4+得電子轉化為Si,所以Si優先于Cu被氧化,故D錯誤;
故選C。


 手拉手全優練考卷系列答案
手拉手全優練考卷系列答案科目:高中化學 來源: 題型:
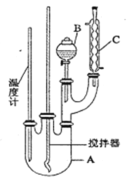
【題目】某科學小組制備硝基苯的實驗裝置如下,有關數據列如下表。已知存在的主要副反應有:在溫度稍高的情況下會生成間二硝基苯。
物質 | 熔點/℃ | 沸點/℃ | 密度/g.cm-1 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 難溶于水 |
間二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
濃硝酸 | 83 | 1.4 | 易溶于水 | |
濃硫酸 | 338 | 1.84 | 易溶于水 |
實驗步驟如下:
取100mL燒杯,用20 mL濃硫酸與足量濃硝酸配制混和酸,將混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室溫下的苯中逐滴加入混酸,邊滴邊攪拌,混和均勻。在50~60℃下發生反應,直至反應結束。
將反應液冷卻至室溫后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗滌。分出的產物加入無水CaCl2顆粒,靜置片刻,棄去CaCl2,進行蒸餾純化,收集205~210℃餾分,得到純硝基苯18g。
回答下列問題:
(1)圖中裝置C的作用是_______________________________。
(2)制備硝基苯的化學方程式__________________________________________________。
(3)敘述配制混合酸操作:______________________________________________。
(4)為了使反應在50℃~60℃下進行,常用的方法是______________。反應結束并冷卻至室溫后A中液體就是粗硝基,粗硝基苯呈黃色的原因是________________________(用化學方程式說明),除去該有色物質選擇的試劑是____________,分離提純的方法為___________,涉及的離子方程式為_______________。
(5)在洗滌操作中,第二次水洗的作用是________________________________________。
(6)在蒸餾純化過程中,因硝基苯的沸點高于140℃,應選用空氣冷凝管,不選用水直形冷凝管的原因是_______________________________________________________________。
(7)本實驗所得到的硝基苯產率是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
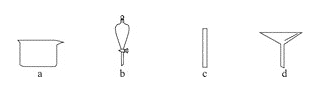
【題目】實驗室需要0.1mol·L-1 NaOH溶液450 mL。根據溶液的配制情況回答下列問題。
(1)在下圖所示儀器中,配制上述溶液肯定不需要的是 _____________(填序號),除圖中已有儀器外,配制上述溶液還需要的玻璃儀器 _____________________。
(2)配制時,其正確的操作順序是(用字母表示,每個操作只用一次) __________。
A.用少量水洗滌燒杯2次~3次,洗滌液均注入容量瓶,振蕩
B.在盛有NaOH固體的燒杯中加入適量水溶解
C.將燒杯中已冷卻的溶液沿玻璃棒注入容量瓶中
D.將容量瓶蓋緊,反復上下顛倒,搖勻
E.改用膠頭滴管加水,使溶液凹液面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度1 cm~2 cm處
(3)實驗兩次用到玻璃棒,其作用分別是:先用于 ______,后用于 ________。
(4)關于容量瓶的四種敘述:①是配制準確濃度溶液的儀器;②不宜貯存溶液;③不能用來加熱;④使用之前要檢查是否漏水。這些敘述中正確的是 ________。
A.①②③④ B.②③ C.①②④ D.②③④
(5)根據計算用托盤天平稱取的質量為 ____________g。
(6)下列操作配制的溶液濃度偏低的是______。
A.稱量NaOH時,將NaOH放在紙上稱重
B.配制前,容量瓶中有少量蒸餾水
C.配制時,NaOH未冷卻直接定容
D.向容量瓶中轉移溶液時不慎有液滴灑在容量瓶外面
E.定容時俯視刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以電鍍廢渣(Cr2O3、CuO、Fe2O3及CaO)為原料制取銅粉和K2Cr2O7的主要流程如圖:
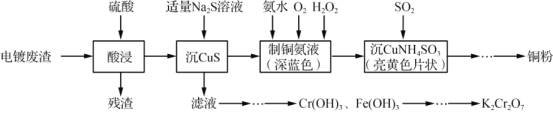
(1)“酸浸”時,所得殘渣的主要成分是___________。
(2)“沉 CuS”時,加入的硫化鈉必須適量,若過量可能產生的后果是_________(用離子方程式表示)。
(3)一水合硫酸四氨合銅加熱到650℃可分解為銅、氨氣、二氧化硫和水以及一種無污染氣體,寫出其化學方程式___________。
(4)“沉CuNH4 SO3”時可用如圖裝置(夾持、加熱儀器略):
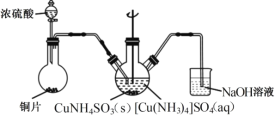
①“沉CuNH4SO3”時,反應液需控制在45℃,合適的加熱方式是____________。
②NaOH溶液的作用是___________。
(5)測定產品中K2Cr2O7含量的方法如下:稱取產品試樣2.0g配成250 mL溶液,用移液管取出25.00 mL于錐形瓶中,加入足量稀硫酸酸化后,再加入幾滴指示劑,用0.1000mol·L–1硫酸亞鐵銨(NH4)2Fe(SO4)2標準液進行滴定,重復進行二次實驗。(已知Cr2O72-被還原為Cr3+)
①若三次實驗消耗(NH4)2Fe(SO4)2標準液的平均體積為25.00mL,則所得產品K2Cr2O7的純度為_____%。[已知M(K2Cr2O7)=294g·mol-1,計算結果保留至小數點后兩位]。
②上述流程中K2Cr2O7發生氧化還原反應后所得溶液中除含有Cr3+外,還含有一定濃度的 Fe3+雜質,可通過加堿調pH的方法使兩者轉化為沉淀。已知c(Cr3+)=2×10–5 mol·L-1,則當溶液中開始析出Cr(OH)3沉淀時Fe3+是否沉淀完全?____________(通過計算說明原因)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應是一類重要的反應,在工農業生產、日常生活中都有廣泛的用途。回答下列有關氧化還原的問題。
Ⅰ.氧化還原反應中實際上包含氧化和還原兩個過程。下面是一個還原過程的反應式:NO3-+4H++3e-→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四種物質中的一種物質(甲)能使上述還原過程發生。
(1)物質(甲)為_________。(填化學式)
(2)反應中若產生標況下4.48LNO氣體,則轉移電子的數目是 ____________。
Ⅱ.亞硝酸鈉(NaNO2)像食鹽一樣有咸味,但有很強的毒性,誤食NaNO2會使人中毒。已知亞硝酸鈉能發生如下反應:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O
(1)用雙線橋標出該反應的電子轉移方向及數目:_______。氧化劑與還原劑的物質的量之比為______。
(2)測定NaNO2的質量分數的過程如下:稱取NaNO2粗品0.6 g于錐形瓶中,先加水溶解,再向其中滴加0.1 mol·L-1酸性KMnO4溶液,恰好完全反應時,消耗酸性KMnO4溶液24mL。計算裝置C中所得固體中NaNO2的質量分數___________。(已知測定過程中發生反應的方程式為MnO4-+NO2-+H+—Mn2++NO3-+H2O(未配平),且雜質不與KMnO4反應)
(3)自來水中的NO3-對人類健康產生危害。為了降低自來水中NO3-的濃度,某研究人員提出兩種方案。
①方案a:微堿性條件下用Fe(OH)2還原NO3-,產物為NH3。生成3.4g NH3同時會生成_____molFe(OH)3。
②方案b:堿性條件下用Al粉還原NO3-,產物是N2。發生的反應可表示如下,完成方程式并配平。
____Al+____NO3-+____ (____)—____AlO2-+______N2↑+____(____)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖所示裝置進行下列實驗:將①中的濃硫酸滴入②中,預測的現象與結論相符的是( )

A. 若②為濃鹽酸;產生大量氣體產生;說明硫酸的酸性比鹽酸強
B. 若②為銅片;有氣泡產生,底部生成灰白色固體;說明濃硫酸有強氧化性
C. 若②為藍色硫酸銅晶體;藍色晶體變為白色;說明濃硫酸有吸水性,發生物理變化
D. 若②為蔗糖;白色固體變為黑色海綿狀,有氣體放出;說明濃硫酸有脫水性、氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將3.48g四氧化三鐵完全溶解在100mL 1mol/L硫酸中,然后加K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部轉為Fe3+,Cr2O72-全部轉化為Cr3+,則K2Cr2O7溶液物質的量濃度是 ( )
A. 0.05mol/LB. 0.1mol/LC. 0.2mol/LD. 0.3mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物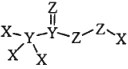 是一種高效消毒劑,其蒸汽和溶液都具有很強的殺菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 為原子序數依次增大的短周期元素。下列敘述正確的是
是一種高效消毒劑,其蒸汽和溶液都具有很強的殺菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 為原子序數依次增大的短周期元素。下列敘述正確的是
A.原子半徑:X>Y>Z
B.元素的非金屬性:X<Y<Z
C.該化合物中Z的化合價均呈-2 價
D.該化合物中 X、Y、Z都滿足 8 電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A,B,C,D,E五種元素,其中A,B,C,D為短周期元素,A元素的周期數、主族數、原子序數相同;B原子核外有3種能量不同的原子軌道且每種軌道中的電子數相同;C原子的價電子構型為csccpc+1,D元素的原子最外層電子數比次外層電子數少2個,D的陰離子與E的陽離子電子層結構相同,D和E可形成化合物E2D.
(1)上述元素中,第一電離能最小的元素的原子結構示意圖為__;D的價電子排布圖為__;
(2)下列分子結構圖中的●和○表示上述元素的原子中除去最外層電子的剩余部分,小黑點表示沒有形成共價鍵的最外層電子,短線表示共價鍵.

則在以上分子中,中心原子采用sp3雜化形成化學鍵的是__(填寫分子的化學式); 在③的分子中有__個σ鍵和__個π鍵.
(3)A,C,D可形成既具有離子鍵又具有共價鍵的化合物,其化學式可能為__;足量的C的氫化物水溶液與CuSO4溶液反應生成的配合物,其化學式為__,請說出該配合物中中心原子與配位體及內界與外界之間的成鍵情況:__.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com