
【題目】甲醛(HCHO)俗稱蟻醛,是一種重要的化工原料。可通過以下方法將甲醇轉化為甲醛。
脫氫法:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09 kJ·mol-1
氧化法:CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
回答下列問題:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64 kJ·mol-1,則ΔH2=_________________。
(2)與脫氫法相比,氧化法在熱力學上趨勢較大,其原因為________________________________________。
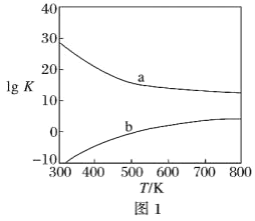
(3)圖1為甲醇制備甲醛反應的lg K(K為平衡常數)隨溫度(T)的變化曲線。曲線_____(填“a”或“b”)對應脫氫法,判斷依據是_____________________________________。
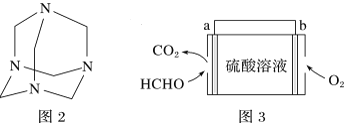
(4)將甲醛水溶液與氨水混合蒸發可制得烏洛托品(結構簡式如圖2),該物質在醫藥等工業中有廣泛用途。若原料完全反應生成烏洛托品,則甲醛與氨的物質的量之比為___________。
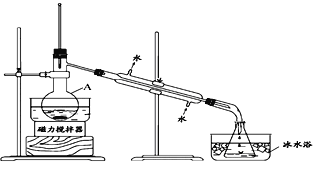
(5)室內甲醛超標會危害人體健康,通過傳感器可以監測空氣中甲醛的含量。一種燃料電池型甲醛氣體傳感器的原理如圖3所示,則a極的電極反應式為_________________________________________________,當電路中轉移4×10-4 mol電子時,傳感器內參加反應的HCHO為________________mg。
【答案】-149.73 kJ·mol-1 脫氫法的反應為吸熱反應,氧化法的反應為放熱反應,放熱反應在熱力學上趨勢較大 b 脫氫法為吸熱反應,溫度升高,K增大 3∶2 HCHO+H2O -4e- = CO2+4H+ 3
【解析】
(1)已知i.CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJmol-1
ii.2H2(g)+O2(g)═2H2O(g)△H3=-483.64kJmol-1,
根據蓋斯定律i+![]() ii得方程式CH3OH(g)+
ii得方程式CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)△H2=(+92.09-
O2(g)=HCHO(g)+H2O(g)△H2=(+92.09-![]() ×483.64)kJ/mol=-149.73kJmol-1;
×483.64)kJ/mol=-149.73kJmol-1;
(2)根據熱化學反應方程式可知脫氫法焓變大于零為吸熱反應,氧化法焓變小于零為放熱反應,放熱反應在熱力學上趨勢較大;
(3)脫氫法為吸熱反應,溫度升高,K增大,所以曲線b對應的是脫氫法;
(4)將甲醛水溶液與氨水混合蒸發可制得烏洛托品,若原料完全反應生成烏洛托品,每個烏洛托品分子中含有6個C原子、4個N原子,每個甲醛分子中含有1個C原子、每個氨氣分子中含有1個N原子,根據C原子、N原子守恒知,要形成一個烏洛托品分子需要6個甲醛分子、4個氨氣分子,則需要甲醛和氨氣分子個數之比=6:4=3:2,即物質的量之比為3:2;
(5)據圖可知a極HCHO被氧化生成CO2,則a為原電池負極,失電子發生氧化反應,電極方程式為HCHO+H2O -4e- = CO2+4H+;根據電極方程式可知轉移4×10-4 mol電子時,參與反應的HCHO為1×10-4mol,質量為1×10-4mol×30g/mol=0.003g=3mg。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】灰錫(以粉末狀存在)和白錫是錫的兩種同素異形體。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列說法正確的是( )
A.△H1>△H2
B.錫在常溫下以灰錫狀態存在
C.灰錫轉為白錫的反應是放熱反應
D.錫制器皿長期處在低于13.2℃的環境中,會自行毀壞
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象所得到的結論正確的是( )
選項 | 實驗操作和現象 | 實驗結論 |
A | 向0.1mol/L碳酸鈉溶液中滴入酚酞,溶液變紅,加熱,紅色加深。 | 碳酸鈉屬于弱堿 |
B | 測定醋酸溶液pH,用玻璃棒蘸取溶液,點在pH試紙上,試紙顯紅色。 | 醋酸溶液顯酸性 |
C | 將銅片和鋅片用導線相連,插入CuSO4溶液中,鋅片質量減小,銅片質量增加。 | 鋅被還原 |
D | 向氯化銀的濁液中滴入KI溶液,濁液中的固體由白色變為黃色。 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以鉻鐵礦(主要成分為FeO·Cr2O3)、碳酸鈉、氧氣和硫酸為原料生產重鉻酸鈉(Na2Cr2O7·2H2O),其主要反應為:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列說法中正確的是
A.反應⑴和⑵均為氧化還原反應
B.反應⑴的氧化劑是O2,還原劑是FeO·Cr2O3
C.高溫下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7時共轉移7mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L的密閉容器中充入2 molX(g)和1 mol Y(g),發生反應2X(g) +Y(g) ![]() 3Z(g) △H,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示,下列推斷正確的是
3Z(g) △H,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示,下列推斷正確的是

A.升高溫度.平衡常數增大
B.W點Y的正反應速率等于M點Y的正反應速率
C.Q點時,Y的轉化率最大
D.平衡時充入3molZ,達到新平衡時Z的體積分數比原平衡時大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組擬從I2-CCl4中提取碘并回收CCl4,查閱資料得到如下信息:
I2 | 紫黑色晶體,沸點184.3°C,易升華,升華后易凝華。在水中的溶解度很小,易溶于許多有機溶劑中 |
CCl4 | 無色有毒液體,沸點76.8℃,易揮發,與水互不相溶,可與乙醇、乙醚、氯仿及石油醚等混溶,不可燃燒,常作有機溶劑。 |
I.興趣小組根據表中信息并結合已學知識,按上圖組裝儀器進行實驗:
(1)該裝置中儀器A的名稱是____________。
(2)錐形瓶置于冰水中的目的是_____________。
(3)實驗結果發現得到的CCl4呈淺紫紅色。為進一步提純CCl4,擬采用除雜分液的方法進行提純,則下列操作次序正確的是:_______________________________。
①靜置,待液體分層后,分液 ②加入稍過量的Na2SO3溶液 ③充分振蕩,放氣 ④將待分離溶液轉移到分液漏斗中 ⑤對分液漏斗進行檢漏
II.由于方法I沒有達到預期目標,興趣小組又設定如下方案進行實驗:
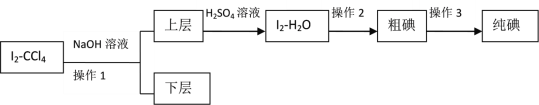
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)操作2的名稱是____________。
(5)滴加少量硫酸時,溶液顏色變黃,試寫出相應的離子方程式:________________。
(6)該實驗中必須要控制NaOH溶液的濃度較_______(填“高”或“低”)和體積較_______(填“大”或“小”),理由是:__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知可逆反應X(g)+2Y(g)![]() 3Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4molY和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法不正確的是
3Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4molY和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法不正確的是
A.若向該容器中加入1molX、2molY,達平衡時,X的平衡濃度等于0.125mol/L
B.a點正反應速率大于逆反應速率
C.反應達平衡時,降低溫度不能實現c到d的轉化
D.該條件下,反應達平衡時,平衡常數K=3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究電化學原理與應用有非常重要的意義。
(1)鋅錳電池(俗稱干電池) 是一種一次電池,生活中應用廣泛。
①鋅錳電池負極上的電極反應式為:______________________________。
②與普通(酸性)鋅錳電池相比較,堿性鋅錳電池的優點是____________________(回答一條即可)。
(2)鉛蓄電池是最常見的二次電池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充電時陰極反應為:________________________________________。
②用鉛蓄電池為電源進行電解飽和食鹽水實驗(石墨棒為陽極,鐵為陰極,食鹽水500mL,溫度為常溫),當電路中有0.05mol電子轉移時,食鹽水的pH為______(假設溶液體積不變,產物無損耗)。
(3)圖1是金屬(M)-空氣電池的工作原理,我國首創的海洋電池以鋁板為負極,鉑網為正極,海水為電解質溶液,電池反應為:___________________________ 。

二氧化硫—空氣質子交換膜燃料電池實現了制硫酸、發電、環保三位一體的結合,原理如圖2所示。Pt2上的電極反應式為:_______________________________________ 。
(4)高鐵酸鈉(Na2FeO4)易溶于水,是一種新型多功能水處理劑,可以用電解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如圖所示。
FeO42+3H2↑,工作原理如圖所示。

裝置通電后,鐵電極附近生成紫紅色的FeO42,鎳電極有氣泡產生。電解一段時間后,c(OH)降低的區域在_____________(填“陰極室”或“陽極室”);陽極反應為:___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋是一個巨大的化學資源寶庫,海水資源綜合利用的部分流程圖。
![]()
(1)由海水提取的粗鹽中常含有![]() 等,可以加入_______________(填化學式)除去,反應的離子方程式為__________________。
等,可以加入_______________(填化學式)除去,反應的離子方程式為__________________。
(2)步驟①反應的離子方程式為__________________。
(3)步驟②中溴單質被SO2還原為![]() ,硫元素被氧化為
,硫元素被氧化為![]() ,從該反應原理中不能得出溴的非金屬性強于硫,其原因是__________________。當有0.25 mol SO2被氧化,轉移的電子的物質的量為__________mol。
,從該反應原理中不能得出溴的非金屬性強于硫,其原因是__________________。當有0.25 mol SO2被氧化,轉移的電子的物質的量為__________mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com