
【題目】2016年諾貝爾化學獎授予在“分子機器設計和合成”領域有突出成就的4位科學家,其研究對象之一為“分子開關”,即與大環(huán)主體分子苯芳烴、硫或氮雜環(huán)杯芳烴等有關。回答下列問題:
(1)對叔丁基杯[4]芳烴(如圖I所示)可用于ⅢB族元素對應的離子萃取,如La2+、Sc2+。寫出基態(tài)二價鈧離子的核外電子排布式____。

(2)對于叔丁基杯[4]芳烴由4個羥基構(gòu)成杯底,羥基中氧原子的雜化方式為____,羥基間的相互作用力為_____。
(3)已知C60分子結(jié)構(gòu)和C60晶胞示意圖如圖所示:
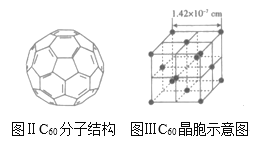
則1個C60分子中含有的![]() 鍵個數(shù)為_____,與1個C60分子距離最近且相等的C60分子有_____個,C60晶體的密度為_____gcm3(寫出表達式)。
鍵個數(shù)為_____,與1個C60分子距離最近且相等的C60分子有_____個,C60晶體的密度為_____gcm3(寫出表達式)。
【答案】1s22s22p63s23p63d1(或[Ar]3d1) sp3 氫鍵 90 12 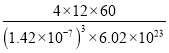
【解析】
(1)Sc為21號元素,核外電子排布式為1s22s22p63s23p63d14s2,失去4s能級2個電子形成Sc2+;
(2)O原子形成2個σ鍵,含有2對孤電子對,雜化軌道數(shù)目=2+2=4;羥基之間形成氫鍵;
(3)每個碳原子形成3個σ鍵,每σ鍵為2個碳原子共有,則平均每個碳原子形成1.5個σ鍵;C60分子處于晶胞頂點、面心位置,以C60頂點為研究,與之最近的C60分子處于面心,每個頂點為8個晶胞共用,每個面為2個晶胞共用,均攤法計算;均攤法計算晶胞中C60分子數(shù)目,計算晶胞質(zhì)量,晶體密度=晶胞質(zhì)量÷晶胞體積。
(1)Sc為21號元素,核外電子排布式為1s22s22p63s23p63d14s2,失去4s能級2個電子形成Sc2+,Sc2+核外電子排布式為:1s22s22p63s23p63d1;
(2)O原子形成2個σ鍵,含有2對孤電子對,雜化軌道數(shù)目=2+2=4,O原子雜化方式為:sp3雜化,羥基之間相互作用為氫鍵;
(3)每個碳原子形成3個σ鍵,每σ鍵為2個碳原子共有,則平均每個碳原子形成1.5個σ鍵,則一個C60分子中含有σ鍵個數(shù)為1.6×60=90,C60分子處于晶胞頂點、面心位置,以C60頂點為研究,與之最近的C60分子處于面心,每個頂點為8個晶胞共用,每個面為2個晶胞共用,與每個C60分子距離最近且相等的C60分子有![]() =12,晶胞中C60分子數(shù)目=8×
=12,晶胞中C60分子數(shù)目=8×![]() +6×
+6×![]() =4,晶胞質(zhì)量m=
=4,晶胞質(zhì)量m=![]() g,則晶體密度ρ=
g,則晶體密度ρ=![]() =
=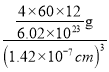 =
=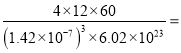 1.67 g/cm3。
1.67 g/cm3。


科目:高中化學 來源: 題型:
【題目】氮是地球上含量比較豐富的一種元素,氮的化合物在工業(yè)生產(chǎn)和生活中有重要的作用。
I.已知298K時,發(fā)生反應:N2O4(g) ![]() 2NO2(g)
2NO2(g)
(1)反應達到平衡后,壓縮容器的體積,再次達到平衡時混合氣體的顏色 ____(填“變深”、“變淺”或“不變”)。
(2)恒容密閉容器中發(fā)生上述反應,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=___________(用k正、k逆表示)。若初始壓強為100kPa,k正=2.8×104s-1,當NO2的體積分數(shù)為40%時,v正=__________kPa·s-1。[其中p(N2O4)和p(NO2)分別是N2O4和NO2的分壓,分壓=p總×氣體體積分數(shù),k正、k逆為速率常數(shù)]
Ⅱ.在催化劑作用下,H2可以還原NO消除污染,反應為:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=akJ·mol-1
N2(g)+2H2O(g) △H=akJ·mol-1
(3)若每生成7g N2放出166kJ的熱量,則a=____。
(4)該反應分兩步進行:
①2NO(g)+H2(g)![]() N2(g)+H2O2(g) △H1
N2(g)+H2O2(g) △H1
②H2O2(g)+H2(g)![]() 2H2O(g) △H2
2H2O(g) △H2
已知:i.總反應分多步進行時,較慢的一步?jīng)Q定總反應速率;
III.總反應的速率表達式v=kc2(NO)·c(H2)(k為速率常數(shù),只和溫度有關)。由上述信息可知,正反應的活化能較低的是____(填“①”或“②”)。
(5)將2molNO和1molH2充入一個恒容的密閉容器中,經(jīng)相同時間測得N2的體積分數(shù)與溫度的關系如圖所示。低于900K時,N2的體積分數(shù)_____(填“是”或“不是”)對應溫度下平衡時的體積分數(shù),原因是_____。高于900K時,N2的體積分數(shù)降低的可能原因是____。
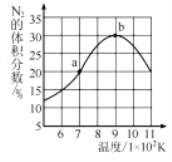
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組利用反應:Cu+2Fe3+=Cu2++2Fe2+設計的原電池實驗裝置如圖。請回答下列問題:
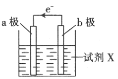
(1)b極發(fā)生___(填“氧化”或“還原”)反應,其電極材料為___,b電極反應式為:____。
(2)a極為____(填“正極”或“負極”),其電極材料可能為___,a極的電極反應式為____。
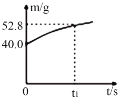
(3)該電池放電過程中,若測得電解質(zhì)溶液的質(zhì)量與時間的關系如圖所示,則反應從開始至t1時,電路中轉(zhuǎn)移電子的物質(zhì)的量為_______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖所示的實驗,能達到實驗目的的是( )
A. 驗證化學能轉(zhuǎn)化為電能
驗證化學能轉(zhuǎn)化為電能
B. 證明溫度對平衡移動的影響
證明溫度對平衡移動的影響
C. 驗證鐵發(fā)生析氫腐蝕
驗證鐵發(fā)生析氫腐蝕
D. 驗證AgCl溶解度大于Ag2S
驗證AgCl溶解度大于Ag2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B為單質(zhì),C為化合物。能實現(xiàn)上述轉(zhuǎn)化關系的是( )
A+B![]() C
C![]() C溶液
C溶液![]() A+B
A+B
①若C溶于水后得到強堿溶液,則A可能是Na
②若C溶液遇Na2CO3放出CO2氣體,則A可能是H2
③若C溶液中滴加KSCN溶液顯血紅色,則B可能為Fe
④若C溶液中滴加NaOH溶液有藍色沉淀生成,則B可能為Cu
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸亞鐵鋰LiFePO4是一種新型汽車鋰離子電池的電極材料。某化工廠以鐵紅、鋰輝石LiAl(SiO3)2(含少量Ca2+、Mg2+的鹽)、碳粉等原料來生產(chǎn)磷酸亞鐵鋰。其主要工藝流程如圖:

已知:2LiAl(SiO3)2+H2SO4(濃)![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
溫度/℃ | 20 | 40 | 60 | 80 | |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)從濾渣Ⅰ中可分離出Al2O3,如圖所示。請寫出生成沉淀的離子方程式___。
![]()
(2)濾渣Ⅱ的主要成分是:___(填化學式)。
(3)向濾液Ⅱ中加入飽和Na2CO3溶液,過濾后,用“熱水洗滌”的原因是___。
(4)寫出在高溫下生成磷酸亞鐵鋰的化學方程式:___。
(5)磷酸亞鐵鋰電池總反應為:FePO4+Li![]() LiFePO4,電池中的固體電解質(zhì)可傳導Li+。試寫出該電池放電時的正極反應:___。若用該電池電解飽和食鹽水(電解池電極均為惰性電極),當電解池兩極共有4480mL氣體(標準狀況)產(chǎn)生時,該電池消耗鋰的質(zhì)量為___。
LiFePO4,電池中的固體電解質(zhì)可傳導Li+。試寫出該電池放電時的正極反應:___。若用該電池電解飽和食鹽水(電解池電極均為惰性電極),當電解池兩極共有4480mL氣體(標準狀況)產(chǎn)生時,該電池消耗鋰的質(zhì)量為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結(jié)構(gòu)簡式如下,下列有關該有機物的敘述中不正確的是
![]()
A. 其分子式為 C9H10O
B. 能使酸性高錳酸鉀溶液褪色
C. 一定條件下,1mol 該有機物理論上最多能與 4mol H2 發(fā)生加成反應
D. 一定條件下,1mol 該有機物理論上最多能與 4mol Br2 發(fā)生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲同學向做過銀鏡反應的試管滴加0.1mol/L的Fe(NO3)3溶液(pH=2),發(fā)現(xiàn)銀鏡部分溶解,和大家一起分析原因:
甲同學認為:Fe3+具有氧化性,能夠溶解單質(zhì)Ag。
乙同學認為:Fe(NO3)3溶液顯酸性,該條件下NO3-也能氧化單質(zhì)Ag。
丙同學認為:Fe3+和NO3-均能把Ag氧化而溶解。
(1)生成銀鏡反應過程中銀氨溶液發(fā)生_____________(氧化、還原)反應。
(2)為得出正確結(jié)論,只需設計兩個實驗驗證即可。
實驗I:向溶解了銀鏡的Fe(NO3)3的溶液中加入____________(填序號,①KSCN溶液、②K3[Fe(CN)6]溶液、③稀HC1),現(xiàn)象為___________,證明甲的結(jié)論正確。
實驗Ⅱ:向附有銀鏡的試管中加入______________溶液,觀察銀鏡是否溶解。
兩個實驗結(jié)果證明了丙同學的結(jié)論。
(3)丙同學又把5mLFeSO4溶液分成兩份:第一份滴加2滴KSCN溶液無變化;第二份加入1mL0.1mol/LAgNO3溶液,出現(xiàn)白色沉淀,隨后有黑色固體產(chǎn)生(經(jīng)驗證黑色固體為Ag顆粒),再取上層溶液滴加KSCN溶液變紅。根據(jù)上述的實驗情況,用離子方程式表示Fe3+、Fe2+、Ag+、Ag之間的反應關系_______________。
(4)丁同學改用如圖實驗裝置做進一步探究:

①K剛閉合時,指針向左偏轉(zhuǎn),此時石墨作_________,(填“正極”或“負極。此過程氧化性:Fe3+_______Ag+(填>或<)。
②當指針歸零后,向右燒杯中滴加幾滴飽和AgNO3溶液,指針向右偏轉(zhuǎn)。此過程氧化性:Fe3+_______Ag+(填>或<)。
③由上述①②實驗,得出的結(jié)論是:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】As2O3在醫(yī)藥、電子等領域有重要應用。某含砷元素(As)的工業(yè)廢水經(jīng)如圖1流程轉(zhuǎn)化為粗產(chǎn)品。
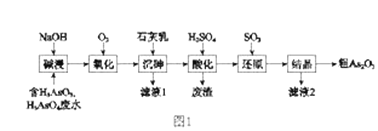
(1)“堿浸”的目的是將廢水中的H3AsO3和H3AsO4轉(zhuǎn)化為鹽。H3AsO4轉(zhuǎn)化為Na3AsO4反應的化學方程式是_______________________________。
(2)“氧化”時,1molAsO33-轉(zhuǎn)化為AsO43-至少需要O2______ mol。
(3)“沉砷”是將砷元素轉(zhuǎn)化為Ca5(AsO4)3OH沉淀,發(fā)生的主要反應有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳溫度是85℃。 用化學平衡原理解釋溫度高于85℃后,隨溫度升高沉淀率下降的原因是_____________________。
(4)“還原”過程中H3AsO4轉(zhuǎn)化為H3AsO3,反應的化學方程式是_______________________。
(5)“還原”后加熱溶液,H3AsO3分解為As2O3,同時結(jié)晶得到粗As2O3。As2O3在不同溫度和不同濃度硫酸中的溶解度(S)曲線如圖2所示。為了提高粗As2O3的沉淀率,“結(jié)晶”過程進行的操作是_______。
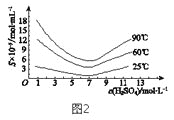
(6)下列說法中,正確的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工業(yè)生產(chǎn)中,濾液2可循環(huán)使用,提高砷的回收率
c.通過先“沉砷”后“酸化”的順序,可以達到富集砷元素的目的
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com