
【題目】向FeBr2、FeI2的混合溶液中通入適量氯氣,溶液中某些離子的物質的量變化如圖所示,下列有關說法中不正確的是( )
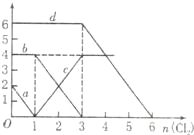
A.d曲線代表溶液中Br﹣變化情況
B.原溶液中FeI2的物質的量為2mol
C.原溶液中n(Fe2+):n(Br﹣)=2:3
D.當通入2mol Cl2時,溶液中離子反應為:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
【答案】B
【解析】
試題分析:首先根據氧化還原反應中:氧化劑的氧化性>氧化產物的氧化性,還原劑的還原性>還原產物的還原性,氧化劑先氧化還原性強的離子,再氧化還原性弱的離子,判斷離子的反應先后順序,然后根據圖象判斷參加反應的各離子的物質的量,以此解答該題.
解:A.反應2Fe2++Br2=2Fe3++2Br﹣中,還原劑Fe2+的還原性強于還原產物Br﹣,所以還原性:Fe2+>Br﹣,反應2Fe3++2I﹣=2Fe2++I2中,還原劑I﹣的還原性強于還原產物Fe2+,所以還原性:I﹣>Fe2+,所以還原性I﹣>Fe2+>Br﹣,則通入氯氣,先與碘離子反應,再與Fe2+反應,a對應氯氣與碘離子的反應,c對應氯氣與亞鐵離子反應,當加3mol氯氣時溴離子開始反應,則d曲線代表溶液中Br﹣變化情況,故A正確;
B.通入氯氣后,碘離子先被氧化,其次是亞鐵離子,最后是溴離子,在通入氯氣的量為0~1mol的過程中,碘離子從最大量降到0,即得到碘離子的物質的量為2mol,通入氯氣的量為1~3mol的過程中,亞鐵離子從4mol降到0,三價鐵的量逐漸增大,所以含有亞鐵離子共4mol,在通入氯氣的量為3~6mol的過程中溴離子從6ml降到0,所以溴離子的物質的量是6mol,即FeBr2的物質的量為3mol,FeI2的物質的量為1mol,故B錯誤;
C.由B可知,亞鐵離子是4mol,溴離子的物質的量是6mol,n(Fe2+):n(Br﹣)=2:3,故C正確;
D.當通入2molCl2時,2mol的I﹣消耗氯氣1mol,余下的1mol氯氣再與2molFe2+反應,即溶液中發生的離子反應可表示為2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣,故D正確.
故選B.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
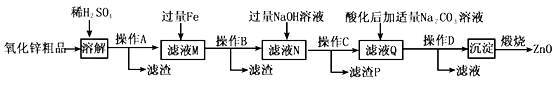
【題目】活性氧化鋅用作橡膠硫化的活性劑、補強劑。以氧化鋅粗品(含鐵的氧化物、CuO和SiO2等雜質)為原料制備活性氧化鋅并生產其它副產品的生產工藝流程如下:
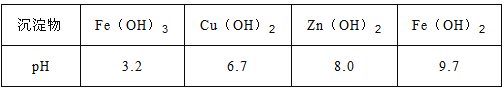
已知:Zn(OH)2可溶于NaOH溶液。一些陽離子以氫氧化物形式完全沉淀時溶液的pH見下表:
(1)操作A所用的玻璃儀器有燒杯、漏斗和______________。
(2)“溶解”前將氧化鋅粗品粉碎成細顆粒,目的是____________________。
(3)加入過量鐵可回收的金屬是_______________。
(4)常溫下若向濾液N中加入適量的H2O2溶液,再加一定量某試劑調節溶液pH=5,則Fe3+濃度為__________(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](鐵氰化鉀)驗證N中Fe2+的現象是___________。
(6)“沉淀”的成分為ZnCO3·2Zn(OH)2·H2O,“煅燒”在450~500℃下進行,煅燒獲得ZnO的反應的化學方程式為_____________________。
(7)取20.00mL濾渡N,用0.02mol/L的KMnO4溶液進行滴定,消耗KMnO4溶液18.00mL,則濾液N中Fe2+的濃度為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是化學實驗室中最常見的有機物,它易溶于水并有特殊香味,能進行如圖所示的多種反應。

(1)寫出D的官能團名稱_____________________。
(2)寫出反應③的化學方程式____________________。
(3)發生反應①時鈉在____________________。(填“液面上”或“液體底部”)。
(4)寫出反應②的反應類型___________。
(5)比B多一個碳原子的B的同系物,在一定條件下可發生聚合反應,生成一種高分子化合物,請寫出該反成的化學方程式______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.0.5mol/LFe2(SO4)3溶液中,SO42-的數目為1.5NA
B.7.1gCl2與足量NaOH溶液反應轉移的電子數為0.2NA
C.5.6 g鐵與0.1 mol氯氣充分反應轉移電子數為 0.2NA
D.在0.1mol藍礬晶體和1L 0.1moL·L![]() AlCl3溶液中,金屬陽離子總數均小于0.1NA
AlCl3溶液中,金屬陽離子總數均小于0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列選項中,有關實驗操作、現象和結論都正確的是( )
選項 | 實驗操作 | 現 象 | 結 論 |
A | 將過量的CO2通入CaCl2溶液中 | 無白色沉淀出現 | 生成的Ca(HCO3)2可溶于水 |
B | 常溫下將Al片插入濃硫酸中 | 無明顯現象 | Al片和濃硫酸不反應 |
C | 用玻璃棒蘸取濃氨水點到紅色石蕊試紙上 | 試紙變藍色 | 濃氨水呈堿性 |
D | 將SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S水溶液中存在電離平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中
H++S2-,若向H2S溶液中
A.加水,平衡向右移動,溶液中氫離子濃度增大
B.通入過量SO2氣體,平衡向左移動,溶液pH值增大
C.滴加新制氯水,平衡向左移動,溶液pH值減小
D.加入少量硫酸銅固體(忽略體積變化),溶液中所有離子濃度都減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時純水的電離度為a1,pH=2的醋酸溶液中水的電離度為a2,pH=12的氫氧化鈉溶液中水的電離度為a3。若將上述醋酸與氫氧化鈉溶液等體積混合,所得溶液中水的電離度為a4。下列關系式中正確的是
A.a2 = a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下CH3COOH和NH3·H2O的電離常數相等,向10ml濃度為0.1mol/L的CH3COOH溶液中滴加相同濃度的氨水,在滴加過程中
A.水的電離程度始終增大
B. 先增大再減小
先增大再減小
C.c(CH3COOH)與c(CH3COO-)之和始終保持不變
D.當加入氨水的體積為10mL時c(NH4+)=c(CH3COO-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com