
【題目】A、B、C、D、E都是短周期主族元素,原子序數依次增大,B、C同周期,A、D同主族。A、B能形成兩種液態化合物甲和乙,原子個數比分別為2∶1和1∶1,E元素形成的簡單離子是同周期元素中離子半徑最小的。根據以上信息回答下列問題:
(1)甲、乙兩分子中含有非極性共價鍵的物質的電子式是__________________,C元素在周期表中的位置是_________________________;
(2)C和D的離子中,半徑較小的是_____________;(填離子符號)。
(3)將D的單質投入甲中,待D消失后再向上述溶液中加入E的單質,此時發生反應的離子方程式是______________________________________________________;
(4)C、D、E可組成離子化合物DxEC6,其晶胞(晶胞是在晶體中具有代表性的最小重復單元)結構如下圖所示,陽離子D+(用○表示)位于正方體的棱的中點和正方體內部;陰離子EC6x-(用●表示)位于該正方體的頂點和面心。該化合物的化學式是___________________。
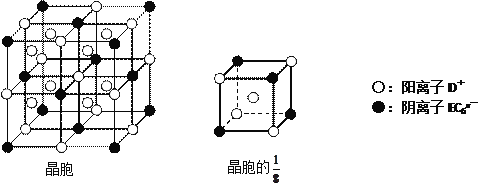
【答案】 ![]() 第二周期、第ⅦA族 Na+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Na3AlF6
第二周期、第ⅦA族 Na+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Na3AlF6
【解析】本題考查的是位置、結構和性質的關系以及應用,明確元素的推斷是解答的關鍵,熟悉元素周期表和元素周期律即可解答。
A、B、C、D、E都是短周期主族元素,原子序數依次增大。A、B能形成兩種液態化合物甲和乙,原子個數比分別為2∶1和1∶1,說明A為氫元素,B為氧元素,二者形成水和雙氧水兩種物質,B、C同周期,則C為氟元素,A、D同主族,則D為鈉元素,E元素形成的簡單離子是同周期元素中離子半徑最小的,為鋁元素。(1)根據以上分析,甲為水,乙為雙氧水,兩分子中含有非極性共價鍵的物質即雙氧水,電子式是![]() ,C為氟元素,在周期表中的位置是第二周期、第ⅦA族。(2)氟離子和鈉離子是電子層結構相同的離子,根據序小徑大分析,半徑較小的是Na+。(3)將鈉的單質投入水中,反應生成氫氧化鈉和氫氣,待鈉消失后再向氫氧化鈉溶液中加入鋁的單質,此時鋁和氫氧化鈉反應生成偏鋁酸鈉和氫氣,反應的離子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)該晶胞的1/8中含有的鈉離子個數為
,C為氟元素,在周期表中的位置是第二周期、第ⅦA族。(2)氟離子和鈉離子是電子層結構相同的離子,根據序小徑大分析,半徑較小的是Na+。(3)將鈉的單質投入水中,反應生成氫氧化鈉和氫氣,待鈉消失后再向氫氧化鈉溶液中加入鋁的單質,此時鋁和氫氧化鈉反應生成偏鋁酸鈉和氫氣,反應的離子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)該晶胞的1/8中含有的鈉離子個數為![]() ,陰離子個數
,陰離子個數![]() ,所以其化學式中陰陽離子個數之比為1:3,化學式為Na3AlF6。
,所以其化學式中陰陽離子個數之比為1:3,化學式為Na3AlF6。


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案科目:高中化學 來源: 題型:
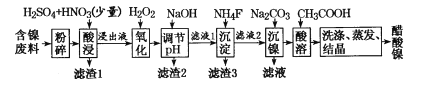
【題目】醋酸鎳((CH3COO)2Ni]是一種重要的化工原料。一種以含鎳廢料(含NiS、Al2O3、FeO、CaO、SiO2)為原料,制取醋酸鎳的工藝流程圖如下:
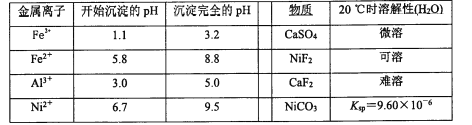
相關離子生成氫氧化物的pH和相關物質的溶解性如下表:
(1)粉碎含鎳廢料的作用__________________________________
(2)酸浸過程中,l molNiS失去6NA個電子,同時生成兩種無色有毒氣體。寫出該反應的化學方程式:___。
(3)寫出氧化步驟中加入H2O2發生反應的離子方程式:____。
(4)調節pH除鐵、鋁步驟中,溶液pH的調節范圍是____。
(5)濾渣3主要成分的化學式是____。
(6)沉鎳過程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL該濾液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],則需要加入Na2CO3固體的質量最少為____g(保留一位小數)。
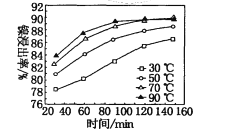
(7)保持其他條件不變,在不同溫度下對含鎳廢料進行酸浸,鎳浸出率隨時間變化如圖。酸浸的最佳溫度與時間分別為____℃、______min。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知 As元素的部分信息如圖所示,下列說法不正確的是

A. H3AsO4和H3PO4都能與NaOH溶液反應生成相應的鹽
B. 熱穩定性:AsH3、H2S、HCl逐漸增強
C. As的一種核素表示為![]() ,中子數為40
,中子數為40
D. 原子半徑由大到小的順序:As、Cl、Si
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下向100mLFeCl3溶液中通入0.224L H2S,生成單質硫,再加入過量鐵粉,反應停止后溶液中含有0.06mol陽離子。原FeCl3溶液的物質的量濃度是
A. 0.2 mol/L B. 0.3 mol/L C. 0.4 mol/L D. 0.6 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ni為第Ⅷ 族元素,在許多工業生產中都有涉及。
已知草酸鎳晶體(NiC2O4·2H2O)難溶于水,工業上從廢鎳催化劑(成分主要為Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制備草酸鎳晶體的流程如圖所示:

已知:①相關金屬離子生成氫氧化物沉淀的pH如下表:
金屬離子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
開始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③當某物質濃度小于1.0×10-5 mol/L時,視為完全沉淀
(1)請寫出一種能提高酸浸速率的措施________________。
(2)試劑a是一種綠色氧化劑,寫出“氧化”時反應的離子方程式__________________________。
(3)pH的調控范圍為 __________________,濾渣Ⅱ的成分為_____________________________。
(4)寫出“沉鎳”時反應的離子方程式___________________________________________,證明Ni2+已經沉淀完全的實驗步驟及現象是______________________________________,當Ca2+沉淀完全時,溶液中c(F-)>_____________ mol/L(寫出計算式即可)。
(5)操作a的內容是____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是部分短周期元素化合價與原子序數的關系圖,下列說法不正確的是

A. 氣態氫化物的穩定性:R>W
B. X與Y可以形成原子個數比為1:1和1:2的兩種離子化合物
C. 由X、Y、Z、W、R五種元素形成的簡單離子中半徑最小的是X2-
D. Y和Z兩者最高價氧化物對應的水化物能相互反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學利用下列裝置探究Na與CO2反應的還原產物,已知PdCl2+CO+H2O==Pd(黑色)↓+CO2+2HCl。下列相關分析錯誤的是
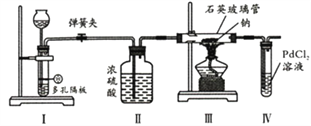
A. I中發生反應可以是Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
B. II中濃硫酸的目的是干燥CO2
C. 實驗時,III中石英玻璃管容易受到腐蝕
D. 步驟IV的目的是證明還原產物是否有CO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測定氣體摩爾體積的實驗中,以下情況不影響測定結果的是( )
A.鎂條表面的氧化膜未完全擦去B.鎂帶中含有不與酸反應的雜質
C.反應后沒有用注射器抽氣D.硫酸過量,鎂全部反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com